
【题目】我国秦俑彩绘和汉代器物上用的颜料被称为“中国蓝”、“中国紫”,直到近年来人们才研究出来其成分为BaCuSi4O10,BaCuSi2O6。
(1)“中国蓝”、“中国紫”中均具有Cun+离子,n=___,基态时该阳离子的价电子排布式为______。
(2)“中国蓝”的发色中心是以Cun+为中心离子的配位化合物,其中提供孤对电子的是___元素。
(3)合成“中国蓝”、“中国紫”的原料有BaCO3,孔雀石Cu2(OH)2CO3和砂子(SiO2)。SiO2晶体中Si原子的杂化轨道是由______轨道(填轨道的名称和数目)和________轨道杂化而成的。
(4)现代文物分析发现,“中国蓝”中含有微量硫元素。假若硫元素来源一种阴离子是正四面体的天然钡矿中,则最可能的钡矿化学式是______。
(5)在5500年前,古代埃及人就己经知道如何合成蓝色颜料—“埃及蓝”CaCuSi4O10,其合成原料中用CaCO3代替了BaCO3,其它和“中国蓝”一致。CO32一中键角∠OCO为___。根据所学,从原料分解的角度判断“埃及蓝”的合成温度比“中国蓝”更___(填“高”或“低”)。
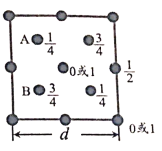
(6)自然界中的SiO2,硬度较大,主要原因是___。下图为SiO2晶胞中Si原子沿z轴方向在xy平面的投影图(即俯视投影图),其中O原子略去,Si原子旁标注的数字表示每个Si原子位于z轴的高度,则SiA与SiB的距离是_____。
【答案】2 ![]() O或氧 1个3s 3个3p
O或氧 1个3s 3个3p ![]()
![]() 低
低 ![]() 是一种空间网状的共价晶体,共价键结合较为牢固
是一种空间网状的共价晶体,共价键结合较为牢固 ![]()
【解析】
⑴根据化合物中各元素的化合价代数和为零来计算n值,Cu2+ 的价电子排布式根据铜原子的价电子排布式3d104s1 得出。
⑵“中国蓝”中![]() 、Si都不存在孤对电子,而O原子中存在孤对电子。
、Si都不存在孤对电子,而O原子中存在孤对电子。
⑶SiO2是空间网状结构,一个Si原子周围连有4个O原子。Si原子核外最外层有4个电子,恰好与氧原子形成4个σ键,无孤对电子。而杂化轨道用于形成σ键和容纳孤对电子。所以SiO2中Si的杂化类型是sp3,也就是1个3s轨道和3个3p轨道形成。
⑷含有硫元素的阴离子是正四面体,最可能是硫酸根。
⑸碳酸根中C提供4个电子,O不提供电子,加两个负电荷,6个电子形成3对电子,属于sp2杂化,平面正三角形,键角为![]() ,对于碱土金属,同主族从上到下离子半径递增,碳酸盐的热稳定性递增,
,对于碱土金属,同主族从上到下离子半径递增,碳酸盐的热稳定性递增,![]() 比
比![]() 稳定。
稳定。
⑹![]() 是一种空间网状的原子晶体,共价键结合较为牢固,SiA与SiB 在y轴方向上距离为
是一种空间网状的原子晶体,共价键结合较为牢固,SiA与SiB 在y轴方向上距离为![]() ,在z轴方向上距离为
,在z轴方向上距离为![]() ,所以SiA与SiB之间的距离
,所以SiA与SiB之间的距离![]() 。
。
⑴根据化合物中所有元素化合价代数和为0可计算出Cu的化合价为+2,故Cun+离子中n=2,Cu的价电子排布式3d104s1,当失去2个电子时价电子排布式变为![]() ,故答案为2,
,故答案为2,![]() ;
;
⑵“中国蓝”中![]() ,Si都不存在孤对电子,而O原子中存在孤对电子,所以只能氧原子来提供孤对电子,故答案为:O;
,Si都不存在孤对电子,而O原子中存在孤对电子,所以只能氧原子来提供孤对电子,故答案为:O;
⑶SiO2中Si的杂化类型是sp3,也就是1个3s轨道和3个3p轨道形成,故答案为:1个3s,3个3p;
⑷含有硫元素的阴离子是正四面体,最可能是硫酸根,所以钡矿化学式是![]() ,故答案为:
,故答案为:![]() ;
;
⑸碳酸根中C属于sp2杂化,平面正三角形,键角为![]() ,对于碱土金属碳酸盐的热稳定性
,对于碱土金属碳酸盐的热稳定性![]() 比
比![]() 稳定,从原料分解的角度判断“埃及蓝”的合成温度比“中国蓝”更低,故答案为:
稳定,从原料分解的角度判断“埃及蓝”的合成温度比“中国蓝”更低,故答案为:![]() ,低;
,低;
⑹![]() 是一种空间网状的原子晶体,共价键结合较为牢固,SiA与SiB 在y轴方向上距离为
是一种空间网状的原子晶体,共价键结合较为牢固,SiA与SiB 在y轴方向上距离为![]() ,在z轴方向上距离为
,在z轴方向上距离为![]() ,所以SiA与SiB之间的距离
,所以SiA与SiB之间的距离![]() ,故答案为:
,故答案为:![]() 是一种空间网状的原子晶体,共价键结合较为牢固,
是一种空间网状的原子晶体,共价键结合较为牢固,![]() ;
;


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】类比推理是学习化学的重要的思维方法,下列陈述Ⅰ及类比推理陈述Ⅱ均正确的是( )
陈述Ⅰ | 类比推理陈述Ⅱ | |
A | 单质的熔点Br2 < I2 | 单质的熔点Li < Na |
B | 工业上电解熔融的Al2O3得到铝单质 | 工业上电解熔融的MgO得到镁单质 |
C | 还原性:I- > Br- | 还原性:P3- > N3- |
D | 溶解度:CaCO3<Ca(HCO3)2 | 溶解度:Na2CO3<NaHCO3 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将气体 X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应:X(g)+Y(g) ![]() 2Z(g) ΔH<0。一段时间后达到平衡,反应过程中测定的数据如表,下列说法正确的是
2Z(g) ΔH<0。一段时间后达到平衡,反应过程中测定的数据如表,下列说法正确的是

A.反应前2min的平均速率v(Z)<2.0×103mol·L-1·min-1
B.其他条件不变,降低温度,反应达到新平衡前:v(逆)>v(正)
C.保持其他条件不变,起始时向容器中充入0.32mol气体X和0.32mol气体Y,到达平衡时,c(Z)>0.24mol·L-1
D.该温度下此反应的平衡常数:K=1.44
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作正确的是
A. 制乙酸乙酯时,将乙醇注入浓硫酸中,冷却后加入乙酸
B. 向溴乙烷中滴加硝酸酸化的AgNO3溶液,以检验其中的溴元素
C. 用氢氧化钠溶液清洗盛过苯酚的试管
D. 在试管中加入2mL2%的CuSO4溶液,然后加入4至6滴10%的NaOH溶液振荡、再加入几滴乙醛溶液加热煮沸,可以检验乙醛分子中的醛基
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己烷雌酚的一种合成路线如下:

下列叙述不正确的是
A. 在NaOH水溶液中加热,化合物X可发生消去反应
B. 在一定条件下,1mol化合物Y可消耗4molBr2
C. 用FeCl3溶液可鉴别化合物X和Y
D. 化合物X与Y中手性碳原子数目比为1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL0.10mol·L-1HClO溶液中逐滴加入0.10mol·L-1NaOH溶液,滴定过程中溶液中水电离出的c(H+)变化曲线如图所示。下列说法正确的是
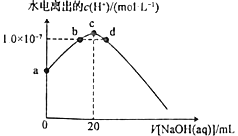
A.可用pH试纸测定a点溶液的pH
B.b、c、d三点溶液中离子、分子种类不同
C.a、b、c、d四点溶液中水的电离程度:c>b=d>a
D.d点溶液中c(Na+)=c(ClO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一水合甘氨酸锌是一种矿物类饲料添加剂,结构简式如图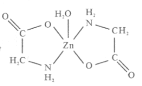 。
。
(1)基态Zn2+的价电子排布式为_______________;一水合甘氨酸锌中所涉及的非金属元素电负性由大到小的顺序是___________________。
(2)甘氨酸(H2N-CH2-COOH)中N的杂化轨道类型为______________;甘氨酸易溶于水,试从结构角度解释___________________________________________。
(3)一水合甘氨酸锌中Zn2+的配位数为______________________。
(4) [Zn(IMI)4](ClO4)2是Zn2+的另一种配合物,IMI的结构为![]() ,则1 mol IMI中含有________个σ键。
,则1 mol IMI中含有________个σ键。
(5)常温下IMI的某种衍生物与甘氨酸形成的离子化合物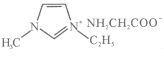 为液态而非固态,原因是________________________________________。
为液态而非固态,原因是________________________________________。
(6)Zn与S形成某种化合物的晶胞如图Ⅰ所示。
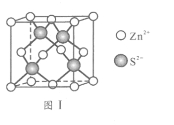
①Zn2+填入S2-组成的________________空隙中;
②由①能否判断出S2- 、Zn2+相切?_________(填“能”或“否”);已知晶体密度为d g/cm3,S2-半径为a pm,若要使S2-、Zn2+相切,则Zn2+半径为____________________pm(写计算表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中,所使用的装置(部分夹持装置略)、试剂和操作方法都正确的是 ( )
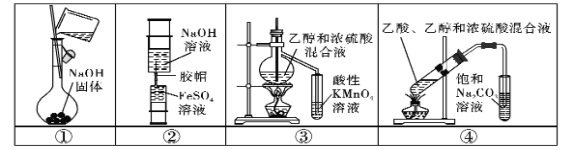
A.用装置①配制250 mL0.1 mol.L-1的NaOH溶液
B.用装置②制备少量Fe(OH)2固体
C.用装置③验证乙烯的生成
D.用装置④制取少量乙酸乙酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某高分子化合物R的结构简式如图,下列有关R的说法正确的是

A. R的单体之一的分子式为C9H12O2
B. R可通过加聚和缩聚反应合成,R完全水解后生成2种产物
C. R是一种有特殊香味,难溶于水的物质
D. 碱性条件下,1 mol R完全水解消耗NaOH的物质 的量为n(m+1)mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com