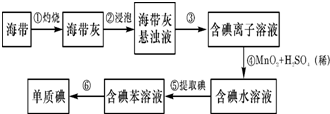
分析:由图可知,从开始至加入NaOH溶液10mL,没有沉淀生成,说明原溶液中盐酸溶解Mg、Al后盐酸有剩余,此时发生的反应为:HCl+NaOH=NaCl+H
2O,继续滴加NaOH溶液,到氢氧化钠溶液为50mL时,沉淀量最大,此时为Mg(OH)
2和Al(OH)
3,溶液为氯化钠溶液.再继续滴加NaOH溶液,氢氧化铝与氢氧化钠反应生成偏铝酸钠与水,发生反应Al(OH)
3+NaOH=NaAlO
2+2H
2O.
(1)由图可知,从加入10m氢氧化钠溶液开始产生沉淀,加入氢氧化钠溶液为50mL时,沉淀量最大,此时为Mg(OH)
2和Al(OH)
3,该阶段消耗氢氧化钠40mL,由氢氧根守恒可知3n[Al(OH)
3]+2n[Mg(OH)
2]=n(NaOH)=(0.06L-0.02L)×1mol/L=0.04mol.从加入氢氧化钠溶液50mL~60mL溶解氢氧化铝,该阶段发生反应Al(OH)
3+NaOH=NaAlO
2+2H
2O,所以n[Al(OH)
3]=(0.06L-0.05L)×1mol/L=0.01mol,代入上式计算n[Mg(OH)
2],由元素守恒可知n(Mg)=n[Mg(OH)
2],再利用m=nM计算Mg、Al的质量;
(2)加入氢氧化钠溶液为60mL时,沉淀量最大,此时为Mg(OH)
2和Al(OH)
3,溶液为氯化钠溶液,根据钠元素守恒此时溶液中n(NaCl)=n(NaOH),据此计算出n(HCl),再利用c=
计算盐酸的物质的量浓度;
(3)到沉淀量最大,此时为Mg(OH)
2和Al(OH)
3,n[Mg(OH)
2]=0.005mol,n[Al(OH)
3]=0.01mol,根据m=nM计算.
解答:
解:由图可知,从开始至加入NaOH溶液10mL,没有沉淀生成,说明原溶液中盐酸溶解Mg、Al后盐酸有剩余,此时发生的反应为:HCl+NaOH=NaCl+H
2O.继续滴加NaOH溶液,到氢氧化钠溶液为50mL时,沉淀量最大,此时为Mg(OH)
2和Al(OH)
3,溶液为氯化钠溶液.再继续滴加NaOH溶液,氢氧化铝与氢氧化钠反应生成偏铝酸钠与水,发生反应Al(OH)
3+NaOH=NaAlO
2+2H
2O.
(1)由图可知,从加入10m氢氧化钠溶液开始产生沉淀,加入氢氧化钠溶液为50mL时,沉淀量最大,此时为Mg(OH)
2和Al(OH)
3,该阶段消耗氢氧化钠40mL,由氢氧根守恒可知3n[Al(OH)
3]+2n[Mg(OH)
2]=n(NaOH)=(0.06L-0.02L)×1mol/L=0.04mol.从加入氢氧化钠溶液50mL~60mL溶解氢氧化铝,该阶段发生反应Al(OH)
3+NaOH=NaAlO
2+2H
2O,所以n[Al(OH)
3]=(0.06L-0.05L)×1mol/L=0.01mol,故3×0.01mol+2n[Mg(OH)
2]=0.04mol,解得n[Mg(OH)
2]=0.005mol,由元素守恒可知n(Mg)=n[Mg(OH)
2]=0.005mol,故m(Al)=0.01mol×27g?mol
-1=0.27g,m(Mg)=0.005mol×24g?mol
-1=0.12g,
答:该镁铝合金的中:Al为0.27g,Mg为0.12g;
(2)加入氢氧化钠溶液为50mL时,沉淀量最大,此时为Mg(OH)
2和Al(OH)
3,溶液为氯化钠溶液,根据钠元素守恒此时溶液中n(NaCl)=n(NaOH)=0.05L×1mol/L=0.05mol,根据氯元素守恒n(HCl)=0.05mol,故盐酸的物质的量浓度为
=0.5mol/L,
答:盐酸的物质的量浓度为0.5mol/L;
(3)B点到沉淀量最大,此时为Mg(OH)
2和Al(OH)
3,n[Mg(OH)
2]=0.005mol,n[Al(OH)
3]=0.01mol,m(沉淀)=m[Mg(OH)
2]+m[Al(OH)
3]=0.005mol×58g/mol+0.01mol×78g/mol=1.07g,
答:B点沉淀的质量为1.07g.

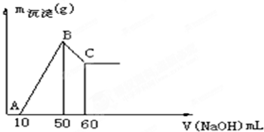 把一小块镁铝合金溶于100mL盐酸中,然后向其中滴入1mol?L-1 NaOH溶液,生成沉淀的质量和加入NaOH溶液的体积如图所示.
把一小块镁铝合金溶于100mL盐酸中,然后向其中滴入1mol?L-1 NaOH溶液,生成沉淀的质量和加入NaOH溶液的体积如图所示.

 全能测控一本好卷系列答案
全能测控一本好卷系列答案