

分析 (1)第二步反应②为:N2O2(g)+O2(g)?2NO2,根据盖斯定律①+②可得:2NO(g)+O2(g)?2NO2(g),总的热化学方程式-①可得②;可逆反应到达平衡时正逆速率相等;
(2)慢反应决定整个过程的反应速率;决定总反应速率是反应②,温度升高后反应①平衡向右移动,造成N2O2浓度减小,温度升高对于反应②的影响弱于N2O2浓度减小的影响,N2O2浓度减小导致反应②速率变慢;
(3)电解法处理氮氧化合物原理是将NOx在电解池中分解成无污染的N2和O2除去,两电极间是固体氧化物电解质,在一定条件下可自由传导O2-,阴极发生还原反应,阴极上是NOx获得电子生成N2与O2-;
(4)在2NO(g)+2CO(g)?2CO2(g)+N2(g)的反应体系,当质量一定时,增大固体催化剂的表面积可提高化学反应速率,反应速率加快,缩短到达平衡的时间,不影响平衡移动,平衡时一氧化氮的浓度不变;
解答 解:(1)第二步反应②为:N2O2(g)+O2(g)?2NO2,根据盖斯定律①+②可得:2NO(g)+O2(g)?2NO2(g),总的热化学方程式-①可得②,则反应②的热化学方程式为:N2O2(g)+O2(g)=2NO2(g)△H2=△H-△H1 ,平衡时正逆反应速率相等,k正c2(NO)=k逆c(N2O2),k=$\frac{c({N}_{2}{O}_{2})}{{c}^{2}(NO)}$,k逆=k正×$\frac{1}{k}$
故答案为:N2O2(g)+O2(g)=2NO2(g)△H2=△H-△H1 ;k正×$\frac{1}{k}$;
(2)慢反应决定整个过程的反应速率,决定总反应速率是反应②,温度升高后反应①平衡向右移动,造成N2O2浓度减小,温度升高对于反应②的影响弱于N2O2浓度减小的影响,N2O2浓度减小导致反应②速率变慢,
故答案为:决定总反应速率是反应②,温度升高后反应①平衡向右移动,造成N2O2浓度减小,温度升高对于反应②的影响弱于N2O2浓度减小的影响,N2O2浓度减小导致反应②速率变慢;
(3)电解法处理氮氧化合物原理是将NOx在电解池中分解成无污染的N2和O2除去,两电极间是固体氧化物电解质,在一定条件下可自由传导O2-,阴极发生还原反应,阴极上是NOx获得电子生成N2与O2-,电极反应式为:2NOx+4xe-=N2+2xO2-,
故答案为:2NOx+4xe-=N2+2xO2-;
(4)在2NO(g)+2CO(g)?2CO2(g)+N2(g)的反应体系,当质量一定时,增大固体催化剂的表面积可提高化学反应速率,反应速率加快,缩短到达平衡的时间,不影响平衡移动,平衡时一氧化氮的浓度不变,在图中画出该反应体系反应进程可能的曲线为: ,
,
故答案为: .
.
点评 本题考查电解原理的分析应用.化学平衡有关计算与影响因素,侧重对化学平衡的影响因素考查,注意化学平衡常数只受温度影响,题目难度较大,答题时注意题中信息的灵活运用.


科目:高中化学 来源: 题型:选择题
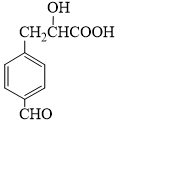
| A. | 能发生缩聚反应 | B. | 能发生消去反应 | ||
| C. | 1mol X最多消耗5 mol H2 | D. | 1mol X最多消耗2 mol Na |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20 g D2O 含有的质子数为10NA | |
| B. | 1mol Na2O2与足量水反应转移的电子数为NA,生成的气体在标况下的体积为22.4L | |
| C. | 1L 0.1mol/L HF溶液中含有共价键数目为0.1 NA | |
| D. | NA个Fe(OH)3胶体粒子的质量为107g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 粗盐在空气中易潮解 | B. | NH4Cl与ZnCl2用于金属焊接中除锈 | ||
| C. | 用热纯碱溶液去油污 | D. | 蒸干并灼烧FeCl3溶液得到Fe2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1molKClO4 | B. | 0.1molKClO3 | C. | 0.2molKClO2 | D. | 0.1molKClO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.4mol | B. | 0.5mol | C. | 0.6mol | D. | 0.8mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径大小顺序:r(Z2+)>r(Y2-) | |
| B. | Y分别与Z、W形成的化合物中化学键类型相同 | |
| C. | X的最高价氧化物对应的水化物的酸性比W的强 | |
| D. | 单质的熔点Z>W |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸可作干燥剂 | B. | SO2可作食品的漂白剂 | ||
| C. | 漂白液可作环境的消毒剂 | D. | KAl(SO4)2•12H2O可作净水剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在熔融状态下,1molNa2O2完全电离出的离子数目为4 NA | |
| B. | 常温下,0.05molCO2和SO2混合气体中所含氧原子数为0.1 NA | |
| C. | 0.1 mol•L-1MgCl2溶液中含有的Mg2+数目一定小于0.1NA | |
| D. | 0.1 mol MnO2与足量的浓盐酸加热反应生成Cl2的体积约为2.24 L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com