
����Ŀ��һ���¶��£���2molSO2��1molO2����һ���ݻ����ܱ������У��ڴ��������½������з�Ӧ��2SO2(g)+O2(g)![]() 2SO3(g) ��H=-197kJ/mol�����ﵽƽ��״̬ʱ������˵������ȷ���ǣ� ��
2SO3(g) ��H=-197kJ/mol�����ﵽƽ��״̬ʱ������˵������ȷ���ǣ� ��
A.�ﵽ��Ӧ��ʱ������SO3Ϊ2mol
B.�ﵽ��Ӧ��ʱ��Ӧ�ų�������С��197kJ
C.�ﵽ��Ӧ��ʱSO2��O2��SO3�ķ�����֮��һ��Ϊ2��1��2
D.�ﵽ��Ӧ��ʱO2���������ʵ���SO3����������
���𰸡�B
��������
A���ﵽ��Ӧ��ʱ����Ӧ�ﲻ����ȫ��ת��Ϊ�������������SO3�����ʵ���ӦС��2mol��A����ȷ��
B��������ʽ��֪��2molSO2��ȫ��Ӧʱ������197kJ�����Դﵽ��Ӧ��ʱ������С��197kJ��B��ȷ��
C����Ӧ���ת����δ֪���ﵽ��Ӧ��ʱ��SO2��O2��SO3�ķ�����֮�Ȳ�һ������2��1��2��C����ȷ��
D���ﵽ��Ӧ��ʱ��O2���������ʵ���SO3���������ʵĶ���֮һ��D����ȷ��
��ѡB��


 ������״Ԫ��ҵϵ�д�
������״Ԫ��ҵϵ�д� ��ʱ�ƿ�������ϰϵ�д�
��ʱ�ƿ�������ϰϵ�д� һ��һ��һ��ͨϵ�д�
һ��һ��һ��ͨϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͼ����NO2(g)��CO(g) ![]() CO2(g)��NO(g)��Ӧ�����������仯��ʾ��ͼ��һ�������£��ڹ̶��ݻ����ܱ������и÷�Ӧ�ﵽƽ��״̬�����ı�����һ������X��Y��X�ı仯��ϵ������ͼ����ʾ��
CO2(g)��NO(g)��Ӧ�����������仯��ʾ��ͼ��һ�������£��ڹ̶��ݻ����ܱ������и÷�Ӧ�ﵽƽ��״̬�����ı�����һ������X��Y��X�ı仯��ϵ������ͼ����ʾ��

�����й�˵����ȷ����
A. һ�������£����ܱ������м���1 mol NO2(g)��1 mol CO(g)��Ӧ�ų�234 kJ����
B. ��X��ʾCO����ʼŨ�ȣ���Y��ʾ�Ŀ�����NO2��ת����
C. ��X��ʾ�¶ȣ���Y��ʾ�Ŀ�����CO2�����ʵ���Ũ��
D. ��X��ʾ��Ӧʱ�䣬��Y��ʾ�Ŀ����ǻ��������ܶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ա���Ϊ��Ҫԭ�ϣ�������ת���ɺϳɸ߷��Ӳ���C����Ҫ���л��ϳ��м���H(���ַ�Ӧ�����Ͳ�������ȥ)

��֪��R1CH2COOCH3+R2COOCH3 +CH3OH
+CH3OH
��ش��������⣺
��1��A��B�ķ�Ӧ������___________��
��2��B��C�Ļ�ѧ����ʽΪ_________��
��3��D������������_________��
��4��E��F�Ļ�ѧ����ʽΪ_______��
��5��G�Ľṹ��ʽ��_________��
��6��F��GΪ������Ӧ���м����Ľṹ��ʽ��_______��
��7�����㻯����M(C8H10O2)��E��ˮ����ﻥΪͬ���칹�壬1molM����2 mol NaOH��Ӧ����˴Ź�����������3����ҷ����֮��Ϊ3��1��1����M�Ľṹ��ʽ��_________��д��һ�ּ��ɣ���
��8����CH3Cl��CH3ONa��NaCNΪԭ��(�������Լ���ѡ)�������Ŀ��֪��Ϣ��д���Ʊ�CH3COCH2 COOCH3�ĺϳ�·�ߣ��ýṹ��ʽ��ʾ�л���ü�ͷ��ʾת����ϵ����ͷ��ע���Լ��ͷ�Ӧ��������__________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�������ܶ�Ϊ1.25g/mL��������Ϊ36.5%��Ũ��������480 mL0.1mol/L�����ᡣ��ش��������⣺
��1��Ũ��������ʵ���Ũ��Ϊ _________��
��2������480 mL0.1 molL��1��������Ҫ�������У��ձ�������������ͷ�ιܡ�_____��_______��
��3������Ͳ��ȡŨ���� ___mL
��4��ʹ������ƿ������Һʱ�����������ʹ������ҺŨ��ƫ�͵���___��
����������ƽ��ʹ�����룩����ʱ�����������������λ�÷ŵߵ���
����Щ�����ܽ����ȣ���δ����ȴ��ת��������ƿ��
����Һת�Ƶ�����ƿ���ձ���������δ������ˮϴ�ӡ�
��ת����Һʱ��������������ƿ�ڽӴ�
�����ݺ�ҡ�ȣ�����Һ�潵�ͣ��ֲ�������ˮ�����´ﵽ�̶���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��ʾ����������ʯī������ʢ�б���NaCl��Һ��U���С����з�����ȷ�ģ���

A. K1�պϣ������Ϸ����ķ�ӦΪ2H����2e��=H2��
B. K1�պϣ�ʯī����Χ��Һ������ǿ
C. K2�պϣ��������ᱻ��ʴ��������������������������
D. K2�պϣ���·��ͨ��0.002NA������ʱ������������0.001mol����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijʵ��С��ͬѧ��������ʵ�飬�Լ��黯ѧ��Ӧ�е������仯����ش��������⣺
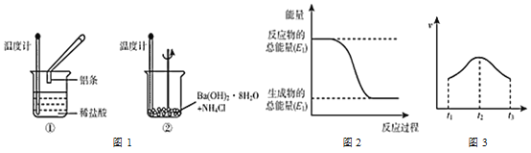
(1)ʵ���з��֣���Ӧ����е��¶�___�����е��¶�___��������ߡ����͡���
(2)������Ӧ�����е������仯����ͼ2��ʾ����___����١��ڡ�����
(3)ʵ����в�ò��������������ʱ��Ĺ�ϵ��ͼ3��ʾ����t2-t3��Ӧ������С����Ҫԭ����___��
(4)д�����з�����Ӧ�����ӷ���ʽ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ᣨH2S2O8��Ϊ��ɫ���壬������ˮ������ˮ����ˮ�⡣
���� | ���� | ������ |
�ṹʽ |
|
|
��1���������������Ľṹʽ������˵����ȷ����______������ţ���
a������������Ϊ���ۻ�����
b. ����������к�������������������ͬ�Ļ�ѧ��
c. ��������ӿɿ���2�����������ȥ1��ˮ����
��2����ҵ�����ù�������Ʊ����������һ�ַ�������ͼ��

�ٵ�ⷨ��(NH4)2S2O8�����У��õ�S2![]() �ĵ缫��Ӧʽ��______��
�ĵ缫��Ӧʽ��______��
�� ��������һ���������ͬʱ��������Һ��S2![]() �������¶ȱ仯��ͼ�����ʱͨ������15������ø����¶ȵ�ԭ��______��
�������¶ȱ仯��ͼ�����ʱͨ������15������ø����¶ȵ�ԭ��______��

��X�Ļ�ѧʽ��______��
�ܹ������ε�ˮ�ⷴӦ______��������������������������������ԭ��Ӧ��
����ͼ��a~e��ʾS2![]() �еIJ��ֻ�ѧ������S2
�еIJ��ֻ�ѧ������S2![]() ����ˮ�ⷴӦʱ���ѵĻ�ѧ����______��ѡ����ĸ����
����ˮ�ⷴӦʱ���ѵĻ�ѧ����______��ѡ����ĸ����

��3��������������������ڷ����̸���MnԪ�صĺ�����ȡ��Ʒa g���������Ũ���ᣬ�ڼ��������½�Mn�ܳ�������b L ���������Һ���ܳ���Mn2+ȫ��ת��Ϊ![]() �����
�����![]() Ũ�ȣ�����ó���Ʒ��MnԪ�ص���������Ϊc��
Ũ�ȣ�����ó���Ʒ��MnԪ�ص���������Ϊc��
�ٸ�ʵ�������������ԣ�S2![]() ______
______![]() ����������������������
����������������������
�ڸù����й��������Һ��Ũ��������______mol/L���ú�a��b��c�Ĵ���ʽ��ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijС���о�SCN-�ֱ���Cu2+��Fe3+�ķ�Ӧ��ʵ���У�c(KSCN) = 0.1 mol/L��c[Fe2(SO4)3] = 0.025 mol/L��c(CuSO4) = 0.05 mol/L��
��. KSCN��Һ��CuSO4��Һ��Ӧ��ʵ�����¡�

���ϣ���.Cu2+����SCN-��Ӧ����CuSCN��ɫ������(SCN)2��
��.(SCN)2��Ϊ����±��������ˮ��Һ�гʻ�ɫ��(SCN)2�Ļ�ѧ������Cl2���ƣ�����ˮ����ȷ�����Ӧ��
��1��a��CuSO4��Һ�����Ե�ԭ����______�������ӷ���ʽ��ʾ����
��2��a��b���Թ�����ҺpH��С�����ܵ�ԭ����______��
��3��b��c����������ԭ����______��
��. ͬѧ�Ǹ�����ͬ�����������ԣ�Fe3+��Cu2+��Ԥ��Fe3+��SCN-Ҳ�ɷ�������a�е�������ԭ��Ӧ����������ʵ�顣
��4����Fe2(SO4)3��Һ�е�������KSCN��Һ���۲쵽______�����������˷�Ӧ��Fe3+ + 3SCN- ![]() Fe(SCN)3��
Fe(SCN)3��
��5�����ڣ�4������ʵ�飺��Fe2(SO4)3��Һ��KSCN��Һ��ʯī�缫����ѹ�������ŵ���װ��ԭ��أ���ѹ��ָ�뼸����ƫת����ʵ���Ŀ����______��
��6���������ϲ����ۺ�ó�����Һ�������ڷ�Ӧʱ�����ֵ�������ǿ������Ӧ��ԭ����ļ�̬��״̬�йء��ɴ˷���a�з�Ӧ������ԭ������CuSCN����ʹCu2+����������ǿ��������ʵ���һ��֤���������ʵ����______��
��7��ȡ��4���з�Ӧ����Һ����μ���K3[Fe(CN)6]��Һ��������ɫ���������ҳ����������ࡣ��ʵ�����루5����ʵ������һ�£�����ԭ��______��
��8��Ϊ��һ��֤ʵ��7���еĽ��ͣ�������ʵ��Ļ����ϲ���ʵ�飬�������������___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ƽ���й���ͳ��ҵ�������˷����Ʊ�Na2CO3һֱ�ڹ�ҵ������������ԭ�����£���NH3+H2O+CO2=NH4HCO3
��NH4HCO3+NaCl=NH4Cl+NaHCO3��
��2NaHCO3![]() Na2CO3+H2O+CO2��
Na2CO3+H2O+CO2��
ij��ѧ��ȤС��ģ���������Ƽ���ƴ�����к���ʵ�顣
��.�Ʊ��������NaCl��NH3��CO2��ˮ��Ϊԭ�ϣ�����ͼ��ʾװ����ȡNaHCO3��Ȼ���ٽ�NaHCO3�Ƴ�Na2CO3��

��1��װ�ñ��з�Ӧ�Ļ�ѧ����ʽΪ____��
��2��װ���ҵ�������___��Ϊ��ֹ��Ⱦ������β���е�___��Ҫ�������մ�����
��3����װ�ñ��в�����NaHCO3��ȡNa2CO3ʱ����Ҫ���е�ʵ�������___��
��.�ⶨ���ò�Ʒ����ɺʹ���
��4�����鴿����Ʒ���Ƿ����NaHCO3����ѡ������װ�����ʵ�飬������±���

ѡ���װ��(����) | ʵ������ | ʵ����� |
___ | ___ | ��Ʒ�к�NaHCO3 |
��5���ⶨ�ô�����Ʒ�Ĵ��ȣ���ȡm1g��Ʒ������С�ձ��У���ˮ�ܽ⣬�μ�����CaCl2��Һ������Ӧ�������ˡ�ϴ�ӡ�����������õ����������Ϊm2g����ô�����Ʒ�Ĵ���Ϊ___��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com