
| A. | 0.3 mol•L-1 Na2SO4溶液中含有Na+和SO42-总物质的量为0.9 mol | |
| B. | 当1 L水吸收22.4 L氨气时所得氨水的浓度不是1 mol•L-1,只有当22.4 L氨气溶于水制得1 L氨水时,其浓度才是1 mol•L-1 | |
| C. | 在K2SO4和NaCl的中性混合水溶液中,如果Na+和SO42-的物质的量浓度相等,则K+和Cl-的物质的量浓度一定相同 | |
| D. | 10℃时0.35 mol•L-1的KCl饱和溶液100 mL,蒸发掉5 g水,冷却到10℃时,其体积小于100 mL,它的物质的量浓度仍为0.35 mol•L-1 |
分析 A.缺少溶液体积,无法计算溶液中钠离子和硫酸根离子的物质的量;
B.没有告诉在标况下,不能使用标况下的气体摩尔体积计算氨气的物质的量;
C.钾离子的浓度是硫酸根的2倍,钠离子和氯离子浓度相等,如果Na+和SO42-的物质的量浓度相等,则K+是Cl-的物质的量浓度的2倍;
D.饱和溶液中溶质的物质的量浓度不变.
解答 解:A.没有告诉硫酸钠溶液的体积,无法计算溶液中钠离子和硫酸根离子的物质的量之和,故A错误;
B.不是标况下,题中条件无法计算22.4L氨气的物质的量,则无法计算该溶液的物质的量浓度,故B错误;
C.硫酸钾中,钾离子浓度是硫酸根浓度的2倍,NaCl中钠离子等于氯离子浓度,由于Na+和SO42-的物质的量浓度相等,故K+是Cl-的物质的量浓度的2倍,故C错误;
D.10℃时0.35 mol•L-1的KCl饱和溶液100 mL,蒸发掉5 g水,冷却到10℃时,其体积小于100 mL,但是此时仍然为饱和溶液,则它的物质的量浓度仍为0.35 mol•L-1,故D正确;
故选D.
点评 本题考查了物质的量浓度的计算与判断,题目难度中等,明确物质的量浓度的概念及表达式为解答关键,试题侧重考查学生的分析能力及灵活应用能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题


| 离子 | 离子半径(pm) | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 74 | 7.6 | 9.7 |
| Fe3+ | 64 | 2.7 | 3.7 |
| Al3+ | 50 | 3.8 | 4.7 |
| Mn2+ | 80 | 8.3 | 9.8 |
| Pb2+ | 121 | 8.0 | 8.8 |
| Ca2+ | 99 | - | - |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某学习小组用如图所示装置测定铝镁合金中铝的质量分数和铝的相对原子质量.
某学习小组用如图所示装置测定铝镁合金中铝的质量分数和铝的相对原子质量.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
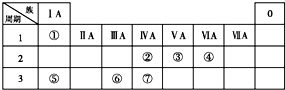 下表为元素周期表的一部分,请参照①~⑦相关元素在表中的位置,用化学用语回答下列问题:
下表为元素周期表的一部分,请参照①~⑦相关元素在表中的位置,用化学用语回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com