
| 阳离子 | Na+ H+ Ba2+ |
| 阴离子 | OH- CO32- SO42- |
分析 生成的气体只有CO2符合,发生的反应为2H++CO32-=H2O+CO2↑,CO2气体可以和C溶液反应生成沉淀E,则C为Ba(OH)2,沉淀E为BaCO3,与B溶液反应,则B为NaHSO4,所以A为Na2CO3,B与C反应生成的白色沉淀D为硫酸钡,根据物质的性质和反应的有关方程式解答该题.
解答 解:生成的气体只有CO2符合,发生的反应为2H++CO32-=H2O+CO2↑,CO2气体可以和C溶液反应生成沉淀E,则C为Ba(OH)2,沉淀E为BaCO3,与B溶液反应,则B为NaHSO4,所以A为Na2CO3,B与C反应生成的白色沉淀D为硫酸钡,
(1)生成的气体只有CO2符合,发生的反应为 2H++CO32-=H2O+CO2↑,CO2名称为二氧化碳,故答案为:二氧化碳;
(2)B为NaHSO4,在溶液中完全电离生成Na+、H+和SO42-,电离方程式为NaHSO4=Na++H++SO42-,检验SO42-时,取B溶液少量,先加盐酸,无明显现象,再加BaCl2溶液产生白色沉淀,
故答案为:取少量生B的溶液于试管,先加入盐酸,再加入BaCl2溶液,生成白色沉淀,则溶液中含有SO42-;
(3)A为Na2CO3,B为NaHSO4,A溶液与B溶液反应的实质为:CO32-+2H+=CO2↑+H2O,
B溶液与C溶液反应至中性的离子方程式为2H++SO42-+Ba2++2OH-=2H2O+BaSO4↓,
故答案为:CO32-+2H+=CO2↑+H2O;2H++SO42-+Ba2++2OH-=2H2O+BaSO4↓;
(4)D与E的混合物ag,加入足量盐酸,发生的反应为BaCO3+2HCl=CO2↑+BaCl2+H2O,
n(CO2)=$\frac{b}{22.4}$mol,n(BaCO3)=n(CO2)=$\frac{b}{22.4}$mol,
m(BaCO3)=$\frac{b}{22.4}$mol×197g/mol=$\frac{197b}{22.4}$g,
m(BaSO4)=ag-$\frac{197b}{22.4}$g,
所以:w(BaSO4)=$\frac{a-\frac{197b}{22.4}}{a}$×100%=$\frac{(22.4a-197b)}{22.4a}$×100%,
故答案为:$\frac{(22.4a-197b)}{22.4a}$×100%.
点评 本题考查离子的推断,为高频考点,把握常见离子之间的反应、白色沉淀的判断为解答的关键,侧重分析与推断能力的考查,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 往溶液中加入适量的氢氧化钠,使溶液中c(Na+)=c(CH3 COO-) | |
| B. | 将溶液与10 mLpH=10的NaOH溶液混合 | |
| C. | 将溶液与10 mL浓度为a mol•L-1的NaOH溶液混合 | |
| D. | 将溶液稀释到10 L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过滤操作时,为了过滤效果好,要用玻璃棒搅拌 | |
| B. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 蒸发操作时,为了防止局部过热,要用玻璃棒搅拌 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2是碱性氧化物 | |
| B. | Na2O2中阴阳离子个数比为1:1 | |
| C. | 可用澄清石灰水来区分Na2CO3 和NaHCO3 | |
| D. | 与同浓度盐酸反应的剧烈程度:NaHCO3>Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
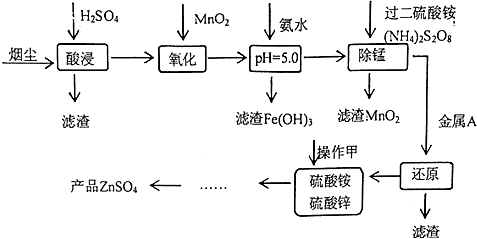
| pH | Fe3+ | Zn2+ | Mn2+ | Cu2+ |
| 开始沉淀 | 1.9 | 6.0 | 8.1 | 4.7 |
| 沉淀完全 | 3.7 | 8.0 | 10.1 | 6.7 |
| 沉淀溶解 | 不溶解 | 10.5 | 不溶解 | / |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
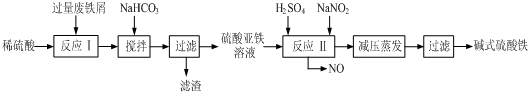
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
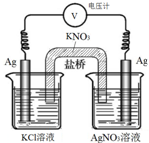 一定条件下,实验室利用如图所示装置,通过测电压求算 Ksp(AgCl).工作一段时间后,两电极质量均增大.下列说法错误的是( )
一定条件下,实验室利用如图所示装置,通过测电压求算 Ksp(AgCl).工作一段时间后,两电极质量均增大.下列说法错误的是( )| A. | 该装置工作时化学能转化为电能 | B. | 左池中的银电极作正极 | ||
| C. | 总反应为Ag+(aq)+Cl-(aq)?AgCl(s) | D. | 盐桥中的K+向右池方向移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com