
| A. | 130ml | B. | 100ml | C. | 90ml | D. | 50ml |
分析 n[Al2(SO4)3]=0.1mol/L×0.1L=0.01mol,如果铝离子完全转化为氢氧化铝,根据Al原子守恒知,最多生成n[Al(OH)3]=2n[Al2(SO4)3]=2×0.01mol=0.02mol,n[Al(OH)3]=$\frac{1.17g}{78g/mol}$=0.015mol<0.02mol,所以有两种情况:一种是Al2(SO4)3过量,只发生反应Al2(SO4)3+6NaOH=3Na2SO4+2Al(OH)3↓;一种情况时,生成的氢氧化铝部分转化为NaAlO2,根据Al2(SO4)3+6NaOH=3Na2SO4+2Al(OH)3↓、Al(OH)3+NaOH=NaAlO2+2H2O进行计算.
解答 解:n[Al2(SO4)3]=0.1mol/L×0.1L=0.01mol,如果铝离子完全转化为氢氧化铝,根据Al原子守恒知,最多生成n[Al(OH)3]=2n[Al2(SO4)3]=2×0.01mol=0.02mol,n[Al(OH)3]=$\frac{1.17g}{78g/mol}$=0.015mol<0.02mol,所以有两种情况:
一种是Al2(SO4)3过量,只发生反应Al2(SO4)3+6NaOH=3Na2SO4+2Al(OH)3↓,
根据知,生成0.015mol Al(OH)3需要n(NaOH)=3n[Al(OH)3]=3×0.015mol=0.045mol,V(NaOH)=$\frac{0.045mol}{0.5mol/L}$=90mL;
一种情况时,生成的氢氧化铝部分转化为NaAlO2,根据Al2(SO4)3+6NaOH=3Na2SO4+2Al(OH)3↓知,完全转化为氢氧化铝沉淀需要n(NaOH)=6n[Al2(SO4)3]=6×0.01mol=0.06mol,根据Al原子守恒知,完全转化为n[Al(OH)3]=2n[Al2(SO4)3]=2×0.01mol=0.02mol,实际上得到0.015mol氢氧化铝,则溶解的n[Al(OH)3]=0.02mol-0.015mol=0.005mol;
根据Al(OH)3+NaOH=NaAlO2+2H2O知,溶解0.005mol氢氧化铝需要n(NaOH)=n[Al(OH)3]=0.005mol,所以最终需要n(NaOH)=0.06mol+0.005mol=0.065mol,则V(NaOH)=$\frac{0.065mol}{0.5mol/L}$=130mL,
故选AC.
点评 本题考查化学方程式有关计算,为高频考点,明确NaOH的物质的量决定氢氧化铝生成量是解本题关键,易错点是不考虑氢氧化铝溶解的反应,为易错题.


 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:选择题
 +3Fe+6HCl→
+3Fe+6HCl→ +3FeCl2+2H2O,产物苯胺还原性强,易被氧化,则由甲苯合成对氨基苯甲酸的步骤合理的是( )
+3FeCl2+2H2O,产物苯胺还原性强,易被氧化,则由甲苯合成对氨基苯甲酸的步骤合理的是( )| A. | 甲苯$\stackrel{硝化}{→}$X$\stackrel{氧化甲基}{→}$Y$\stackrel{还原硝基}{→}$对氨基苯甲酸 | |
| B. | 甲苯$\stackrel{氧化甲基}{→}$X$\stackrel{硝化}{→}$Y$\stackrel{还原硝基}{→}$对氨基苯甲酸 | |
| C. | 甲苯$\stackrel{还原}{→}$X$\stackrel{氧化甲基}{→}$Y$\stackrel{硝化}{→}$对氨基苯甲酸 | |
| D. | 甲苯$\stackrel{硝化}{→}$X$\stackrel{还原硝基}{→}$Y$\stackrel{氧化甲基}{→}$对氨基苯甲酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应中有水参加反应 | |
| B. | 反应后溶液呈无色 | |
| C. | 该反应的还原剂为K2S2O8 | |
| D. | MnSO4和K2S2O8的化学计量数分别为、2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
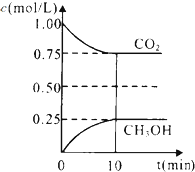 二氧化碳是引起“温室效应”的主要物质,节能减排,高效利用能源,能够减少二氧化碳的排放.在一定温度下的2L固定容积的密闭容器中,通入2molCO2和3mol H2,发生的反应为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),△H=-a kJ•mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示.
二氧化碳是引起“温室效应”的主要物质,节能减排,高效利用能源,能够减少二氧化碳的排放.在一定温度下的2L固定容积的密闭容器中,通入2molCO2和3mol H2,发生的反应为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),△H=-a kJ•mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Fe2O3、Fe3O4、FeO | B. | FeO、Fe3O4 | C. | Fe3O4、Fe2O3 | D. | FeO、Fe2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 难溶电解质 | Mg(OH)2 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 溶解度/g | 9×10-4 | 1.7×10-6 | 1.5×10-4 | 3.0×10-9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com