
【题目】下列实验操作正确的是( )
A. 用酒精萃取碘水中的碘
B. 分液时,分液漏斗中的两层液体均从下口放出
C. 蒸馏时,应将温度计水银球靠近蒸馏烧瓶支管口处
D. 称量NaOH固体时,将氢氧化钠固体放在托盘天平左盘的纸上
 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,回答下列问题。

(1)写出下列序号表示的元素的符号:
①_________⑤__________⑧__________。
(2)上述10种元素中,金属元素有_____种。
(3)上述10中元素中,最不活泼的元素是________________(用元素名称表示)。
(4)⑨在周期表中的位置是___________。
(5)实验室制取④的最简单氢化物的化学反应方程式是:___________;单质⑦与水反应的离子方程式是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是部分城市某日空气质量日报:
城市 | 污染指数 | 首要污染物 | 空气质量等级 | ||
SO2 | NO2 | PM10 | |||
A | 98 | 23 | 67 | SO2 | Ⅱ |
B | 47 | 29 | 35 | SO2 | Ⅰ |
C | 62 | 80 | 113 | PM10 | Ⅲ |
D | 52 | 76 | 59 | NO2 | Ⅰ |
(1) 由上表可知,空气质量日报中涉及的污染物主要是____________和可吸入颗粒物(PM10)。
(2) 汽车尾气则是城市大气中氮氧化物的主要来源之一。治理方法之一是在汽车排气管上加装“催化转化器”,使CO与NOx反应生成可参与大气生态环境循环的无毒气体,写出反应方程式_______________________________________。
(3) SO2的排放是造成酸雨的主要因素。形成酸雨的原理之一可简单表示如下:
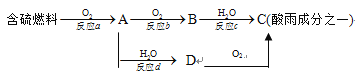
请回答下列问题:
①酸雨的pH____________(填“>”、“<”或“=”)5.6 ;
②反应b的化学方程式为____________________________________;
③在一段时间内连续不断测定溶液D的pH值,发现pH值变小,表示该变化的化学方程式是_________________。
④若用足量的氢氧化钠溶液吸收含二氧化硫的工业废气,写出该反应的离子方程式______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某重要香料F的合成路线有多条,其中一条合成路线如下
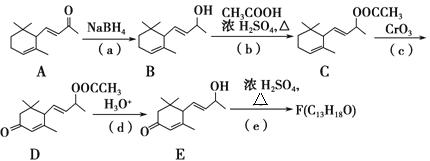
请回答下列问题:
(1)化合物E中含氧官能团的名称为______、__________。
(2)在(a)~(e)反应中,属于取代反应是____。(填编号)
(3)写出E→F的化学反应方程式_______。
(4)写出同时满足下列四个条件的D的一种同分异构体结构简式:_____________。
①该物质属于芳香族化合物
②该分子中有4种不同化学环境的氢原子
③1mol该物质最多可消耗2molNaOH
④该物质能发生银镜反应。
(5)根据已有知识并结合相关信息,已知: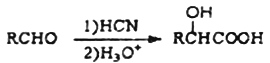
写出以乙醇和![]() 为原料制备
为原料制备![]() 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)_____________
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.自发进行的反应一定是放热反应 B.非自发进行的反应一定是吸热反应
C.自发进行的反应一定能发生 D.有些吸热反应也能自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)用系统命名法命名烃A:_____________________;
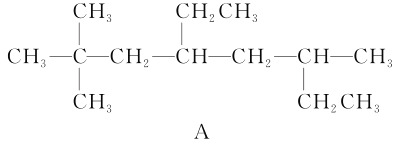
烃A的一氯代物具有不同沸点的产物有________种。
(2)有机物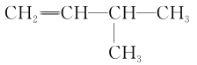 的系统命名是________,将其在催化剂存在下完全氢化,所得烷烃的系统名称是________。
的系统命名是________,将其在催化剂存在下完全氢化,所得烷烃的系统名称是________。
(3)有机物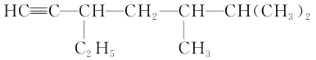 的系统名称是________,将其在催化剂存在下完全氢化,所得烷烃的系统名称是________。
的系统名称是________,将其在催化剂存在下完全氢化,所得烷烃的系统名称是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质性质及其应用的说法,正确的是
A. 碳酸钠溶液呈碱性,可用热的纯碱溶液除去矿物油污渍
B. 氧化铝的熔点很高,可用于制作耐高温材料
C. Cl2、SO2均有漂白性,可使紫色石蕊溶液褪色
D. 钠的金属性强于钾,工业上可用钠制取钾Na+KCl![]() K↑+NaCl
K↑+NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一容积不变的密闭容器中充入一定量A和B,发生如下反应:xA(g)+2B(s)![]() yC(g) ΔH<0在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图所示。请回答下列问题:
yC(g) ΔH<0在一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图所示。请回答下列问题:

(1)根据图示可确定x∶y=________。
(2)用A的浓度变化表示该反应在0~10 min内的平均反应速率v(A)=______________。
(3)0~10 min容器内压强________(填“变大”、“不变”或“变小”)。
(4)推测第10 min引起曲线变化的反应条件可能是____________;第16 min引起曲线变化的反应条件可能是____________。
①减压 ②增大A的浓度 ③增大C的量 ④升温 ⑤降温 ⑥加催化剂
(5)若平衡Ⅰ的平衡常数为K1,平衡Ⅱ平衡常数为K2,则K1____________K2(填“>”、“=”或“<”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com