
| A. | Li2NH中N的化合价是-1 | |
| B. | 此法储氢和钢瓶储氢的原理相同 | |
| C. | 每有1molLi2NH参加反应,则有2mol电子转移 | |
| D. | 该反应中H2既是氧化剂,又是还原剂 |
分析 Li2NH中H元素的化合价是+1,氮元素的化合价为-3;LiNH2中氮元素的化合价为-3,H元素的化合价是+1;LiH中H元素的化合价是-1,可以从化合价变化的角度来判断氧化还原反应的有关概念;离子核外电子层数越多,半径越大;钢瓶储氢是物理过程.
解答 解:A.Li2NH中氮元素的化合价为-3,故A错误;
B.钢瓶储氢是物理过程,而该方法为化学方法,故B错误;
C.Li2NH中H元素的化合价是+1,每有1molLi2NH参加反应,则有1mol电子转移,故C错误;
D.反应物H2中的氢元素的化合价为0价,反应后生成LiNH2中H元素的化合价是+1,LiH中H元素的化合价是-1,所以H2既是氧化剂又是还原剂,故D正确.
故选D.
点评 本题考查氧化还原反应的有关概念,离子半径的大小比较等问题,做题注意从化合价变化的角度判断氧化剂、还原剂的等概念,注意离子半径大小比较的方法,注重基础知识的积累.


 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案科目:高中化学 来源: 题型:选择题
| A. | 2Q2=Q1=92.4 | B. | Q2<Q1<92.4 | C. | Q1=Q2=92.4 | D. | Q1<Q2<92.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 反应时间/min | n(A)/mol | n(B)/mol |
| 0 | 1.00 | 1.20 |
| 10 | 0.50 | |
| 30 | 0.20 |
| A. | 前10min内反应的平均速率为v(C)=0.050mol•L-1•min-1 | |
| B. | 保持其他条件不变,起始时向容器中充入0.50molA气体和0.60molB气体,到达平衡时,n(C)<0.25mol | |
| C. | 若密闭容器体积不变,其他条件不变,在达到平衡后持续缩小容器体积,则平衡一直会正向移动 | |
| D. | 温度为T2℃时(T1>T2),上述反应平衡常数为20,则正反应为放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LH2O所含原子个数大于3NA | |
| B. | 100ml18.4mol/L硫酸与足量Cu反应,生成SO2的分子数为0.92NA | |
| C. | t℃时,MgCO3的Ksp=4×10-6,则饱和溶液中含Mg2+数目为2×10-3NA | |
| D. | 100g质量分数为34.2%的蔗糖分子水溶液中含H原子数为2.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
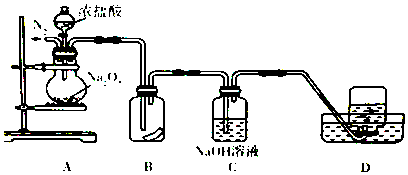
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
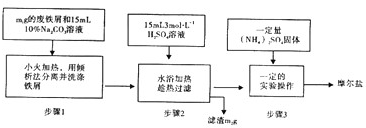
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
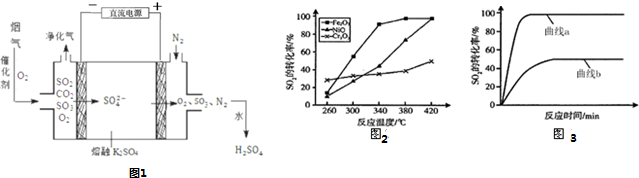
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com