
【题目】如图所示,A处通入潮湿的Cl2,关闭B阀时,C处干燥的红色布条看不到明显现象,打开B阀后,C处红色布条逐渐褪色,则D瓶中装的不可能是( )

A. 浓H2SO4 B. NaOH溶液 C. 澄清石灰水 D. 饱和NaCl溶液
【答案】D
【解析】
次氯酸具有漂白作用而氯气不具有漂白性,所以干燥的氯气不能漂白有色布条,含水蒸气的氯气能使有色布条褪色,A处通入氯气,关闭B阀时,C处的红色布条看不到明显现象,打开B阀后,C处红色布条逐渐褪色,因此说明D中溶液可以吸收氯气或可干燥氯气,据此分析来解答。
A.浓硫酸具有吸水性,氯气通过浓硫酸得到干燥的氯气,故A与题意不符;
B.氯气通过NaOH溶液,与氢氧化钠反应,关闭B阀时,C处的红色布条看不到明显现象,故B与题意不符;
C.氯气通过澄清石灰水,与氢氧化钙反应,关闭B阀时,C处的红色布条看不到明显现象,故C与题意不符;
D.氯气与食盐水不反应,进入C的为潮湿的氯气,关闭B阀时,C处红色布条逐渐褪色,故D符合题意;
答案选D。


科目:高中化学 来源: 题型:
【题目】下列各组物质与其用途的对应关系正确的是( )
选项 | 物质 | 用途 |
A | 硅单质 | 制作光导纤维 |
B | 烧碱 | 治疗胃酸过多 |
C | 铁罐车 | 常温下用于运输浓硝酸 |
D | 液氨 | 用作消毒剂 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 乙烷中含乙烯杂质可以加入氢气反应除去
B. C4H9Br的同分异构体有4种
C. 淀粉溶液中加入KI溶液,液体变蓝色
D. 苯(苯酚):向混合液中加入适量的浓溴水,过滤,除去苯中的少量苯酚
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】十九大报告提出要“打赢蓝天保卫战”,意味对环境污染防治比过去要求更高。
(1)烟气中的氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) H < 0 平衡常数K1
NaNO3(s)+ClNO(g) H < 0 平衡常数K1
2NO(g)+Cl2(g)![]() 2ClNO(g) H < 0 平衡常数K2
2ClNO(g) H < 0 平衡常数K2
4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=__________(用K1、K2表示)。
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=__________(用K1、K2表示)。
(2)利用CO可将NO转化为无害的N2,其反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g)。
N2(g)+2CO2(g)。
在容积均为1 L的甲、乙、丙三个恒温(反应温度分别为300℃、T℃、300℃)容器中分别加入物质的量之比为1:1的NO和CO,测得各容器中n(CO)随反应时间t的变化情况如下表所示:
t/min n(CO) /mol | 0 | 40 | 80 | 120 | 160 |
甲 | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
乙 | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
丙 | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
① 甲容器中,0~40min内用NO的浓度变化表示的平均反应速率v(NO)=_______。
② T ___ 300℃,该反应的△H______0(填“>”或“<”)。
③ 甲容器达平衡时α(NO)=_______。
丙容器达平衡时c(NO)可能为________0.4mol/L(填“>”、“=”或“<”)。
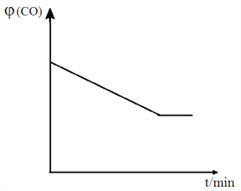
④ 已知甲容器CO的体积分数![]() (CO)随时间t的变化如图,画出其他条件不变,绝热条件下,
(CO)随时间t的变化如图,画出其他条件不变,绝热条件下, ![]() (CO)随时间t的变化示意图。_____________________
(CO)随时间t的变化示意图。_____________________
(3)处理含镉废水常用化学沉淀法。以下是几种镉的难溶化合物25℃时的溶度积常数: Ksp(CdCO3)=5.2×10-12 Ksp(CdS)=3.6×10-29 Ksp(Cd(OH)2)=2.0×10-16,
回答下列问题:
若采用生石灰处理含镉废水最佳pH为11,此时溶液中c(Cd2+)=_________。沉淀Cd2+效果最佳的试剂是____________
a.Na2CO3 b.Na2S c.CaO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增大。m、P、q、r、s是由这些元素组成的二元化合物,常温常压下r为液体,其余均为无色气体。m的摩尔质量为p的2倍,n是元素Y的单质,是绿色植物光合作用产生的无色气体,p物质能使湿润的红色石蕊试纸变蓝,q能使品红溶液褪色。上述物质的转化关系如下图所示。下列说法正确的是

A. q与s均为酸性氧化物 B. 原子半径:W<Y<X
C. Z的氢化物比Y的氢化物稳定 D. Z的含氧酸是一种强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铀是原子反应堆的原料,常见铀的化合物有UF4、UO2、及(NH4)4[UO2(CO3)3]等,回答下列问题:
(1)基态氟原子的价电子排布图为________________;用Mg或Ca还原UF4可得金属铀,其氧化产物MgF2的熔点高于CaF2,原因是_______________________________;
(2)已知:2UO2+5NH4HF2![]() 2UF4·2NH4F+3NH3↑+4H2O↑
2UF4·2NH4F+3NH3↑+4H2O↑
①NH4HF2中存在的微粒间的作用力是__________(填选项字母)。
A.离子键 B.配位键 C.共价键 D.范德华力
②该反应中非金属元素的第一电离能由大到小的顺序是__________(填元素符号)。
(3)已知:3(NH4)4[UO2(CO3)3] ![]() 3UO2+10NH3↑+9CO2↑+ N2↑+ 9H2O↑
3UO2+10NH3↑+9CO2↑+ N2↑+ 9H2O↑
①分解产物中属于非极性分子的是_________(填选项字母)。
A.NH3 B.CO2 C.N2 D.H2O
②反应物中的CO32-的空间构型为_____________。分子中的大![]() 键可用符号
键可用符号![]() 表示,其中m代表参与形成大
表示,其中m代表参与形成大![]() 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大![]() 键的电子数(如苯分子中的大
键的电子数(如苯分子中的大![]() 键可表示为
键可表示为![]() ),则CO32-中的大
),则CO32-中的大![]() 键应表示为______________。
键应表示为______________。
③HN3(氢叠氮酸)常用于引爆剂,其分子的结构式可表示为:![]() 。则左边氮原子和中间氮原子的杂化方式分别为______________、_______________。
。则左边氮原子和中间氮原子的杂化方式分别为______________、_______________。
(4)UO2的晶胞结构如图所示:
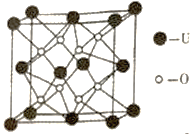
①晶胞中铀原子位于面心和顶点,氧原子填充在铀原子堆积形成的空隙中。则氧原子填充在铀原子形成的___________空隙中。(填“立方体”、“四面体”、“八面体”)
②若两个氧原子间的最短距离为a nm,则UO2晶体的密度为___________g·cm-3(列出计算式即可,设NA表示阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将铁粉放入由盐酸、MgCl2溶液、FeCl3溶液、CuCl2溶液组成的混合液中,充分反应后,铁粉有剩余,则溶液含有大量的阳离子是( )
A.Cu2+和Fe2+
B.H+和Cu2+
C.Fe3+和Fe2+
D.Fe2+和Mg2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用下列装置制备并检验Cl2的性质,下列说法正确的是 ( )


A. Ⅰ图中:如果MnO2过量,浓盐酸就可全部反应
B. Ⅱ图中:生成蓝色的烟
C. Ⅲ图中:用日光照射量筒,量筒中会产生大量白雾,液面会迅速上升
D. Ⅳ图中:a中有色布条褪色,b中不褪色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com