

| ||
| 12g |
| 120g/mol |
| 11 |
| 4 |
| 11 |
| 4 |
| ||


 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:
| A、所有的非金属元素都在p区 |
| B、P原子的价电子排布式为3s23p3 |
| C、过渡元素都在d区 |
| D、当各轨道处于全满、半满、全空时原子较稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、⑤⑧ | B、③⑤⑦⑧ |
| C、③④⑤⑦ | D、④⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 体育竞技中服用兴奋剂既有失公平,也败坏了体育道德.某种兴奋剂的结构简式如下图所示.有关该物质的说法中正确的是( )
体育竞技中服用兴奋剂既有失公平,也败坏了体育道德.某种兴奋剂的结构简式如下图所示.有关该物质的说法中正确的是( )| A、该物质与苯酚属于同系物,遇FeCl3溶液呈紫色 |
| B、滴入酸性KMnO4溶液振荡,紫色褪去,能证明其结构中存在碳碳双键 |
| C、1mol该物质分别与浓溴水和H2反应时,最多消耗Br2和H2分别为4mol和7mol |
| D、该分子中的所有碳原子不可能共平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:
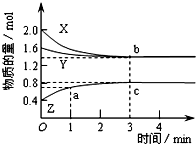 某温度时,在体积为2L的密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示,其中a、b、c三点的坐标分别为(1,0.7)、(3,1.4)、(3,0.8).下列说法中正确的是( )
某温度时,在体积为2L的密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示,其中a、b、c三点的坐标分别为(1,0.7)、(3,1.4)、(3,0.8).下列说法中正确的是( )| A、该反应的化学方程式是3X+Y=2Z |
| B、3 min时,X的转化率为70% |
| C、达平衡时,c(Y)=0.7 mol?L-1 |
| D、前1 min内,v(Z)=0.3 mol?L-1?min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 工业制硫酸时,利用催化氧化反应将SO2转化为SO3是一个的关键步骤.
工业制硫酸时,利用催化氧化反应将SO2转化为SO3是一个的关键步骤.| 1 |
| 2 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、明矾[KAl(SO4)2?12H2O]在水中能形成Al(OH)3胶体,可用作净水剂 |
| B、金刚石是自然界中硬度最大的物质,不可能与氧气发生反应 |
| C、浓H2SO4有强氧化性,不能与Cu发生剧烈反应 |
| D、将SO2通入品红溶液,溶液褪色后加热恢复原色;将SO2通入溴水,溴水色后加热也能恢复原色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| △ |
| A、2molSO2与1molO2能完全反应生成2molSO3,升高温度可以加快此反应的化学反应速率 |
| B、2molSO2与1molO2不能完全反应生成2molSO3,升高温度可以加快此反应的化学反应速率 |
| C、2molSO2与1molO2能完全反应生成2molSO3,升高温度减慢此反应的化学反应速率 |
| D、2molSO2与1molO2不能完全反应生成2molSO3,升高温度减慢此反应的化学反应速率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com