
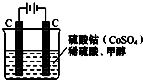
 (1)甲醇(CH3OH)是重要的能源物质,研究甲醇具有重要意义.为提高甲醇燃料的利用率,科学家发明了一种燃料电池,电池的一个电极通入空气,另一个电极通入甲醇气体,电解质是掺入了Y2O3的ZrO2晶体,在高温下它能传导O2-.电池工作时正极反应式为O2+4e-=2O2-.
(1)甲醇(CH3OH)是重要的能源物质,研究甲醇具有重要意义.为提高甲醇燃料的利用率,科学家发明了一种燃料电池,电池的一个电极通入空气,另一个电极通入甲醇气体,电解质是掺入了Y2O3的ZrO2晶体,在高温下它能传导O2-.电池工作时正极反应式为O2+4e-=2O2-.| 离子 | Cu2+ | H+ | Cl- | SO42- |
| c/mol•L-1 | 1 | 4 | 4 | 1 |
分析 (1)根据原电池原理,正极O2得到电子生成O2-;依据电解原理和溶液中离子放电顺序,结合电子守恒和电极反应计算得到;
(2)①通电后,将Co2+氧化成Co3+,电解池中阳极失电子发生氧化反应,电极反应为Co2+-e-=Co3+;
②以Co3+做氧化剂把水中的甲醇氧化成CO2而净化,自身被还原为Co2+,原子守恒与电荷守恒可知,还原生成H+,配平书写为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+;
反应中生成1molCO2转移6mol电子,据此分析.
解答 解:(1)燃料电池中,一个电极通入空气,另一个电极通入甲醇气体,电解质是掺入了 Y2O3的ZrO2晶体,在高温下它能传导O2-离子,
正极O2得到电子生成O2-:O2+4e-=2O2-,电解一段时间后,当两极收集到相同体积(相同条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象),
100ml溶液中含有c(Cu2+)=1mol/L,c(H+)=4mol/L,c(Cl-)=4mol/L,c(SO42-)=1mol/L;
阴阳两极生成的气体的体积相同,设阴极生成的悄悄物质的量为xmol,阳极上也应生成氧气和氯气的物质的量之和xmol
阴极电极反应为:
Cu2++2e-=Cu,
0.1mol 0.2mol 0.1mol
2H++2e-=H2↑;
2xmol xmol
阳极电极反应为:
2Cl--2e-=Cl2↑,4OH--4e-=2H2O+O2↑,
0.4mol 0.4mol 0.2mol 4(x-0.2)(x-0.2)
依据电子守恒0.4+4(x-0.2)=0.2+2x
x=0.3mol,则氧气的物质的量为0.3mol-0.2mol=0.1mol,其体积为2.24L;
故答案为:O2+4e-=2O2-;2.24;
(2)①通电后,将Co2+氧化成Co3+,电解池中阳极失电子发生氧化反应,电极反应为Co2+-e-=Co3+,故答案为:Co2+-e-=Co3+;
②以Co3+做氧化剂把水中的甲醇氧化成CO2而净化,自身被还原为Co2+,该过程中被氧化的元素是C元素,结合原子守恒与电荷守恒可知,还原生成H+,配平书写离子方程式为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+;反应中生成1mol即22.4LCO2转移6mol电子,则当产生标准状况下2.24L CO2时,共转移电子0.6mol,
故答案为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+;C;6.
点评 本题考查了原电池原理的应用、电解池原理的应用等,题目难度中等,侧重于考查学生的分析能力和计算能力,注意把握原电池和电解池中电极反应式的书写方法,以及电子守恒在计算中的应用.


科目:高中化学 来源: 题型:选择题
| A. | NA个氧气分子的体积约为11.2L | |
| B. | 1.8g的NH4+离子中含有的电子数为10NA | |
| C. | 标准状况下,2.24 L氢气和氧气以任意比组成的混合气体,所含的原子数约为0.2NA | |
| D. | 7.8g过氧化钠固体中含有的阴、阳离子的总数约为0.4 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④③①⑤ | B. | ②③⑤① | C. | ④⑤③① | D. | ①②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 充电时电池反应为FePO4+Li═LiFePO4 | |
| B. | 充电时动力电池上标注“+”的电极应与外接电源的负极相连 | |
| C. | 放电时电池内部Li+向正极移动 | |
| D. | 放电时,在正极上是Li+得电子被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2 L Cl2通入含0.5molFeBr2的溶液中转移电子数为1.5NA | |
| B. | 0.1 mol•L-1的AlCl3溶液与足量NaOH溶液反应所得产物中含AlO2-为0.1NA | |
| C. | 足量Zn与浓硫酸共热可生成标准状况下的气体2.24 L,则参加反应的硫酸为0.4 NA | |
| D. | 常温常压下,1.6g甲烷中含有的碳原子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在某密闭容器中充入H2S和O2,发生反应:2H2S(g)+O2(g)?S2(g)+2H2O(g)△H<0,达到平衡后,若仅改变横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势符合图象的是( )
在某密闭容器中充入H2S和O2,发生反应:2H2S(g)+O2(g)?S2(g)+2H2O(g)△H<0,达到平衡后,若仅改变横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势符合图象的是( )| 选项 | x | y |
| A | 温度 | 混合气体平均相对分子质量 |
| B | 压强 | S2气体体积分数 |
| C | 容器体积 | H2S浓度 |
| D | O2浓度 | 平常常数逆反应速率 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使酚酞试液变红的溶液中:S2-、SO42-、SO32-、Na+ | |
| B. | 由水电离出来的c(H+)=10-12mol/L的溶液中:Na+、HCO3-、SO42-、K+ | |
| C. | pH=0的溶液中:Na+、K+、Fe2+、NO3- | |
| D. | pH=7的溶液中:Al3+、Cl-、SO42-、CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com