

 ,故答案为:
,故答案为: ;
;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 阴离子 | OH-、Cl-、C
| ||||||
| 阳离子 | H+、Na+、Al3+、Ag、Ba2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K2CO3+2HNO3═2KNO3+CO2↑+H2O |
| B、Na2CO3+2HCl═2NaCl+CO2↑+H2O |
| C、CaCO3+2HCl═CaCl2+CO2↑+H2O |
| D、(NH4)2CO3+H2SO4═(NH4)2SO4+CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 加热 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
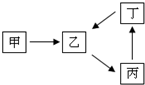 甲、乙、丙、丁四种物质转化关系如右图.已知甲是地壳中含量最高的元素组成的单质,化合物乙、丙、丁均含有第三周期一种相同元素.
甲、乙、丙、丁四种物质转化关系如右图.已知甲是地壳中含量最高的元素组成的单质,化合物乙、丙、丁均含有第三周期一种相同元素.| 温度/℃ | 400 | 450 | 500 | 550 | 600 | 650 |
| 转化率/% | 99.2 | 97.5 | 93.5 | 85.6 | 73.7 | 58.5 |
| 3 |
| 4 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 操作 | 可能的实验现象 | 解释 | |
| A | 某溶液中加入硝酸酸化的氯化钡溶液 | 有白色沉淀生成 | 溶液中一定含有SO42- |
| B | 向淀粉KI溶液中不断通入C12 | 溶液变蓝后褪色 | C12先表现氧化性后 表现漂白性 |
| C | CO还原Fe2O3得到的黑色固体加入 盐酸溶解后再加入KSCN溶液 |
溶液不显红色 | 该黑色固体是Fe |
| D | 将SO2通入BaCl2溶液中 | 没有白色沉淀生成 | BaSO3可溶于酸 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1L 0.1mol?L-1的氯化铵溶液中有nA个NH4+ |
| B、标准状况下,22.4L SO3含有nA个SO3分子 |
| C、常温常压下,8g O2含有0.5nA个氧原子(O:16) |
| D、1mol Na被完全氧化生成Na2O2,失去2nA个电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com