
| A. | CO(NH2)2 | B. | HOCOOH | C. | H2NCH2COOH | D. | CCl4 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
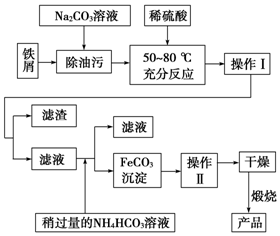 铁、铝和铜等金属及其化合物在日常生活中应用广泛,请根据下列实验回答问题:
铁、铝和铜等金属及其化合物在日常生活中应用广泛,请根据下列实验回答问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
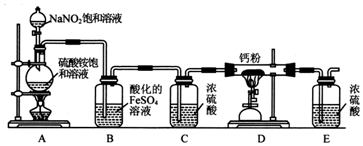
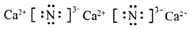 ;连接装置后,检查装置气密性的方法是检查装置气密性的方法是:关闭A中分液漏斗的活塞,向E中加入蒸馏水,微热A中的圆底烧瓶,E中有气泡冒出,冷却后,E中玻璃管形成一段水柱,则气密性良好.
;连接装置后,检查装置气密性的方法是检查装置气密性的方法是:关闭A中分液漏斗的活塞,向E中加入蒸馏水,微热A中的圆底烧瓶,E中有气泡冒出,冷却后,E中玻璃管形成一段水柱,则气密性良好.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| X | 与Al同周期,金属性最强 |
| Y | 与Al同周期,最外层电子数是最内层电子数的3倍 |
| Z | 常温下单质为双原子分子,为黄绿色有毒气体 |
| W | 单质紫黑色,遇淀粉溶液显蓝色 |
 ;W在元素周期表中的位置是第五周期第ⅦA族;
;W在元素周期表中的位置是第五周期第ⅦA族;查看答案和解析>>
科目:高中化学 来源: 题型:实验题
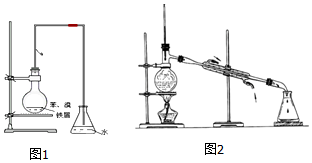 (1)某同学设计如图1装置制取少量溴苯,写出实验室制取溴苯的化学方程式
(1)某同学设计如图1装置制取少量溴苯,写出实验室制取溴苯的化学方程式 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 14g分子式为CnH2n的烃中含有的C-H键的数目一定为2NA | |
| B. | 1mol Fe与水蒸气反应生成的氢气为22.4L | |
| C. | 1mol Mg在空气中完全燃烧生成MgO和Mg3N2,转移的电子数为NA | |
| D. | 0.1mol H2S分子中含氢离子数目为0.2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a+2-m | B. | a+m+n | C. | 2n+3a-m | D. | 2+a+2n-m |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
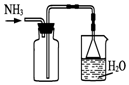 氢氧化铝可用于阻燃和药物等领域.
氢氧化铝可用于阻燃和药物等领域.| 金属离子 | Al3+ | Zn2+ | Mg2+ |
| 与EDTA反应的pH | 4 | 5~6 | 9.5~10 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com