
分析 (1)Cu2O中铜元素的化合价为+1价,反应后被氧化成+2价,化合价至少升高(2-1)×2=2价,N元素从硝酸中的+5价变为+2价,化合价降低3价,化合价变化的最小公倍数为6,然后利用化合价升降相等配平该反应的化学方程式;
(2)根据N原子守恒列式计算出硝酸铜的物质的量;
(3)根据铜元素质量守恒及电子守恒列式计算.
解答 解:(1)Cu2O中铜元素的化合价为+1价,反应后被氧化成+2价,化合价至少升高(2-1)×2=2价,N元素从硝酸中的+5价变为+2价,化合价降低3价,则氧化亚铜的系数为3,NO的系数为2,然后利用质量守恒定律配平可得:3Cu2O+14HNO3=6Cu(NO3)2+2NO↑+7H2O,
故答案为:3Cu2O+14HNO3=6Cu(NO3)2+2NO↑+7H2O;
(2)根据N原子守恒可知生成硝酸铜的物质的量为:n[Cu(NO3)2]=$\frac{0.1L×0.6mol/L-\frac{0.224L}{22.4L/mol}}{2}$=0.025mol,
故答案为:0.025mol;
(3)由Cu元素守恒可得:2×n(Cu20)+n(CuO)+0.01mol=0.025mol,
由氧化还原反应得失电子守恒可知:0.01×2+2×n(Cu20)=$\frac{0.224L}{22.4L/mol}$×3,
解得:n(Cu20)=0.005mol、n(CuO)=0.005mol,
故答案为:0.005mol.
点评 本题考查混合物反应的计算,题目难度中等,明确发生反应实质为解答关键,注意从质量守恒和氧化还原反应得失电子守恒的角度分析,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:解答题
| 反应进程(分钟) | 1 | 2 | 5 | 15 | 20 | |
| 实验1 | 3.0mol/L盐酸 | 少量气泡 | 较多气泡 | 大量气泡 | 反应剧烈 | 铝片耗尽 |
| 实验2 | 1.5mol/L硫酸 | 均无明显现象(无气泡产生) | ||||
| 实验3 | 3.0mol/L硫酸 | 均无明显现象(无气泡产生) | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
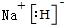 ;RX与X2Q反应的化学方程式为NaH+H2O=NaOH+H2↑.
;RX与X2Q反应的化学方程式为NaH+H2O=NaOH+H2↑.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 35Cl和37Cl的原子结构示意图相同 | |
| B. | 元素H只有11H和21H两种核素 | |
| C. | 元素周期表中位于金属和非金属分界线附近的元素属于过渡元素 | |
| D. | 1mol HCl分子和1mol HF分子断键需要的能量前者大于后者 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (或
(或 、
、 ).
).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2、CsCl、CF4、CBr4 | B. | CsCl、SiO2、CBr4、CF4 | ||
| C. | SiO2、CsCl、CBr4、CF4 | D. | CF4、CBr4、CsCl、SiO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学式 | 电离常数(25℃) |
| CH3COOH | Ka=1.8×10-5 |
| H2SO3 | Ka1=1.23×10-2 Ka2=6.6×10-8 |
| NH3.H2O | Kb=1.8×10-5 |
| A. | 25℃时,pH=3的醋酸和pH=11的氨水等体积混合后,混合液中水的电离是被促进的 | |
| B. | Na2SO3溶液中滴加足量醋酸,反应的离子方程式为:SO32-+2CH3COOH=SO2↑+H2O+2CH3COO- | |
| C. | NaHSO3溶液呈酸性,是因为Kw/Ka1>Ka2 | |
| D. | 0.1mol/L的CH3COOH溶液与等浓度等体积的CH3COONa混合后,溶液中的微粒存在以下关系:c(H+)+c(CH3COOH)=c(CH3COO-)+2c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com