
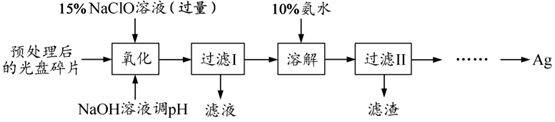
分析 回收一种光盘金属层中的少量Ag,由流程可知,氧化时发生4Ag+4NaClO+2H2O═4AgCl+4NaOH+O2↑,为控制 80℃,可水浴加热,过滤I分离出AgCl、可能含Ag,再加氨水溶解AgCl,发生AgCl+2NH3•H2O?Ag(NH3)2++Cl-+2H2O,过滤II分离出的滤渣为Ag,对过滤II得到的滤液用N2H4•H2O(水合肼)在碱性条件下能还原 Ag(NH3)2+得到Ag,以此来解答.
解答 解:(1)“氧化”阶段需在 80℃条件下进行,不超过水的沸点,则适宜的加热方式为水浴加热,
故答案为:水浴加热;
(2)NaClO 溶液与 Ag 反应的产物为 AgCl、NaOH 和 O2,Ag、O元素的化合价升高,Cl元素的化合价降低,由电子、原子守恒可知该反应的化学方程式为4Ag+4NaClO+2H2O═4AgCl+4NaOH+O2↑. HNO3也能氧化Ag,从反应产物的角度分析,以HNO3代替NaClO的缺点是会释放出氮氧化物(或 NO、NO2 ),造成环境污染,
故答案为:4Ag+4NaClO+2H2O═4AgCl+4NaOH+O2↑;会释放出氮氧化物(或 NO、NO2 ),造成环境污染;
(3)为提高Ag的回收率,需对“过滤Ⅱ”的滤渣进行洗涤,并将洗涤后的滤液合并入过滤Ⅱ的滤液中,减少Ag的损失,
故答案为:将洗涤后的滤液合并入过滤Ⅱ的滤液中;
(4)若省略“过滤Ⅰ”,直接向冷却后的反应容器中滴加10%氨水,则需要增加氨水的用量,除因过量NaClO与NH3•H2O反应外(该条件下NaClO3与NH3•H2O不反应),还因为未过滤掉的溶液会稀释加入的氨水,且其中含有一定浓度的Cl-,不利于AgCl与氨水反应,
故答案为:未过滤掉的溶液会稀释加入的氨水,且其中含有一定浓度的Cl-,不利于AgCl与氨水反应;
(5)由信息③可知,从“过滤Ⅱ”后的滤液中获取单质Ag的实验方案为向滤液中滴加2mol•L-1水合肼溶液,搅拌使其充分反应,同时用1 mol•L-1 H2SO4溶液吸收反应中放出的NH3,待溶液中无气泡产生,停止滴加,静置,过滤、洗涤,干燥,
故答案为:向滤液中滴加2mol•L-1水合肼溶液,搅拌使其充分反应,同时用1 mol•L-1 H2SO4溶液吸收反应中放出的NH3,待溶液中无气泡产生,停止滴加,静置,过滤、洗涤,干燥.
点评 本题考查混合物分离提纯,为高频考点,把握流程中发生的反应、混合物分离提纯方法、实验技能为解答的关键,侧重分析能力和实验能力的考查,注意信息的应用及实验设计,题目难度中等.


 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案科目:高中化学 来源: 题型:解答题
 研究发现,在CO2低压合成甲醇反应(CO2+3H2=CH3OH+H2O)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景.回答下列问题:
研究发现,在CO2低压合成甲醇反应(CO2+3H2=CH3OH+H2O)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤的干馏和石油的分馏都是物理变化 | |
| B. | 1-氯丙烷和2-氯丙烷的消去产物相同 | |
| C. | 正戊烷、异戊烷、新戊烷的沸点逐渐升高 | |
| D. | 除去苯中苯酚,加入溴水后过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油液化气的主要成份为甲烷 | |
| B. | 燃料的脱硫、脱氮都是减少酸雨产生的措施 | |
| C. | BaSO4难溶于水是弱电解质,在医学上用作钡餐 | |
| D. | 磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 反应N2 (g)+3H2 (g)?2NH3 (g)的△H<0,△S>0 | |
| B. | 地下钢铁管道用导线连接锌块可以减缓管道的腐蚀 | |
| C. | 常温下,Ksp[Mg(OH)2]=5.6×10-12,pH=10的含Mg2+溶液中,c(Mg2+ )≤5.6×10-4 mol•L-1 | |
| D. | 常温常压下,锌与稀H2SO4反应生成11.2 L H2,反应中转移的电子数为6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “可燃冰”是将水变为油的新型燃料 | |
| B. | 氢气是具有热值高、无污染等优点的燃料 | |
| C. | 天然气、海洋能、太阳能、生物质能、风能、氢能 都属于新能源 | |
| D. | 电能是一次能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba(OH)2•8H2O与NH4Cl的反应 | B. | NaOH溶液与盐酸的反应 | ||
| C. | 甲烷与氧气的反应 | D. | 石灰石的分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
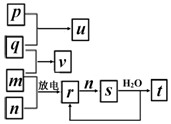 短周期主族元素X、Y、Z、W的原子序数依次增大.在如图所示的物质转化关系中,p、q、m、n分别是元素W、X、Y、Z的气体单质,p和s均为有色气体,v的水溶液呈碱性.常温下,0.1mol•L-1 t溶液与0.1mol•L-1 u溶液的pH 均为1.下列说法不正确的是( )
短周期主族元素X、Y、Z、W的原子序数依次增大.在如图所示的物质转化关系中,p、q、m、n分别是元素W、X、Y、Z的气体单质,p和s均为有色气体,v的水溶液呈碱性.常温下,0.1mol•L-1 t溶液与0.1mol•L-1 u溶液的pH 均为1.下列说法不正确的是( )| A. | Y、W的最高价氧化物对应的水化物均为强酸 | |
| B. | 元素的非金属性:Z>Y>X,原子半径:X<Z<Y | |
| C. | s溶于水的反应中,氧化剂与还原剂的物质的量之比为1:2 | |
| D. | v的电子式可表示为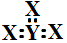 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X和Y只能形成一种化合物 | |
| B. | 原子半径:r(Z)>r(W)>r(Y) | |
| C. | W的简单气态氢化物的热稳定性比Y强 | |
| D. | 元素Z、W的简单离子具有相同的电子层结构 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com