
【题目】如何除去杂质、提纯下列各物质?请在表中填空。
混合物成分 | 提纯所用试剂的化学式 | 离子方程式 |
(1)FeCl2中含少量FeCl3杂质 | _______ | __________________ |
(2)FeCl3中含少量FeCl2杂质 | _______ | __________________ |
(3)FeSO4中含少量CuSO4杂质 | _______ | __________________ |
【答案】Fe Fe+2Fe3+![]() 3Fe2+ Cl2 2Fe2++Cl2
3Fe2+ Cl2 2Fe2++Cl2![]() 2Fe3++2Cl- Fe Fe+Cu2+
2Fe3++2Cl- Fe Fe+Cu2+![]() Cu+Fe2+
Cu+Fe2+
【解析】
(1)FeCl2中含少量FeCl3杂质,利用Fe3+的氧化性,不能引入新的杂质,所以选用的还原剂是Fe,发生的反应为:Fe+2Fe3+![]() 3Fe2+,答案为:Fe;Fe+2Fe3+
3Fe2+,答案为:Fe;Fe+2Fe3+![]() 3Fe2+;
3Fe2+;
(2)FeCl3中含少量FeCl2杂质,利用Fe2+的还原性将FeCl2除去,不能引入新的杂质,选用的氧化剂为Cl2,发生的反应为:2Fe2++Cl2![]() 2Fe3++2Cl-,答案为:Cl2;2Fe2++Cl2
2Fe3++2Cl-,答案为:Cl2;2Fe2++Cl2![]() 2Fe3++2Cl-;
2Fe3++2Cl-;
(3)FeSO4中含少量CuSO4杂质,利用Cu2+氧化性,加入铁粉,发生的反应为:Fe+Cu2+![]() Cu+Fe2+,再过滤,即可除去,答案为: Fe;Fe+Cu2+
Cu+Fe2+,再过滤,即可除去,答案为: Fe;Fe+Cu2+![]() Cu+Fe2+。
Cu+Fe2+。


 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:
【题目】甲酸(HCOOH)是还原性弱酸,常用于橡胶、医药等工业生产,也可用于制备重要的化工原料[Cu(HCOO)2·4H2O]。
I.碱式碳酸铜的制备

(1)“操作i”中研磨的目的是__。
(2)“操作ii”发生的反应是:2CuSO4+4NaHCO3═Cu(OH)2·CuCO3↓+3CO2↑+2Na2SO4+H2O。原料中NaHCO3必须过量的原因是__。反应温度低于80℃的原因是__。
(3)“操作iii”中系列操作包括过滤、__、干燥。
II.甲酸的制备
(4)一定条件下,CO能与NaOH固体发生反应:CO+NaOH![]() HCOONa,再将HCOONa酸化,即可得HCOOH。
HCOONa,再将HCOONa酸化,即可得HCOOH。
①为了证明“CO与NaOH固体发生了反应”,甲同学设计下列验证方案:取少许固体产物,配成溶液,在常温下测其pH,若pH>7,则得证。该方案是否可行__(填“是”或“否”),请简述你的理由:__。
②乙同学设计了另一个定性验证方案:取固体产物,配成溶液,__(请补充完整)。
III.甲酸铜的合成及纯度测定
(5)实验室按Cu(OH)2·CuCO3+4HCOOH+5H2O═2Cu(HCOO)2·4H2O+CO2↑反应制得甲酸铜晶体,按以下步骤测定其纯度。
步骤一:准确称取mg甲酸铜晶体样品,配成250mL溶液;
步骤二:移取25.00mL溶液于锥形瓶中,往溶液中加入足量KI摇匀,用cmol/LNa2S2O3溶液滴定至溶液变浅黄色时,加入10mL10%KSCN试剂,并加几滴淀粉溶液,继续用cmol/LNa2S2O3溶液滴定至终点,共消耗Na2S2O3溶液V1mL。
步骤三:用25.00mL蒸馏水代替甲酸铜溶液,重复步骤二,消耗Na2S2O3溶液V2mL;
已知:CuI难溶于水,能吸附I2;2Cu2++4I-=2CuI↓+I2;I2+2![]() =
=![]() +2I-;CuI(s)+SCN-(aq)
+2I-;CuI(s)+SCN-(aq)![]() CuSCN(s)+I-(aq)
CuSCN(s)+I-(aq)
①配制溶液时用到的玻璃仪器有:烧杯、量筒、玻璃棒和__;
②实验中加入10mL10%KSCN试剂的目的是__。
③甲酸铜晶体的纯度__(列表达式即可,Cu(HCOO)2·4H2O的摩尔质量为226g/mol)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a、b、c、d、e、f、g为七种由短周期元素构成的粒子,它们都有10个电子,其结构特点如下所示:(单位:电荷)
粒子代号 | a | b | c | d | e | f | g |
电荷数 | 0 | +1 | -1 | 0 | +2 | +1 | 0 |
其中b的离子半径大于e的离子半径;c与f可形成两个共价型g分子。试写出:
(1)a粒子的原子结构示意图是______________。
(2)b与e相应元素的最高价氧化物对应水化物的碱性强弱比较为________(用化学式表示)。
(3)若d极易溶于水,在水溶液中变化的方程式为________,实验室制备d气体的化学方程式为________;若d为正四面体形分子,其重要应用之一为________。
(4)c粒子是________,f粒子是________(用化学式表示),由c、f生成g的离子方程式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质性质的叙述正确的是( )
A.SiO2与浓盐酸在高温下能反应生成SiCl4
B.木炭与浓硫酸共热可生成CO2
C.明矾溶液中加入过量NaOH溶液可制备Al(OH)3胶体
D.向饱和食盐水中通入足量CO2可制得NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.室温下,pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合,所得溶液pH>7
B.室温下,Na2CO3溶液中加入少量Ca(OH)2固体,溶液中![]() 的值增大
的值增大
C.在外加电流的阴极保护法中,须将被保护的钢铁设备与直流电源的负极相连
D.反应NH3(g)+HCl(g)=NH4Cl(s)在室温下能自发进行,该反应的ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有甲乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均使用镁片和铝片作电极,但甲同学将电极放入 6mol/L 的硫酸溶液,乙同学将电极放入 6mol/L 的氢氧化钠溶液中,如图所示:
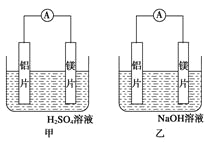
(1)写出甲电池中正极的电极反应式___________________ ;
(2)写出乙池中负极的电极反应式: 负极:_____ 总反应的离子方程式:_________
(3)如果甲与乙同学均认为“构成原电池的电极材料如果都是金 属,则构成负极材料的金属活泼
,则甲会判断出_____活动性更强,而乙会判断出_____活动性更强(填名称)
(4)由此实验,可得到如下哪些正确结论(_____)
a. 利用原电池反应判断金属活动性顺序时应注意选择合适的介质
b. 镁的金属性不一定比铝的强
c. 该实验说明金属活动性顺序表已过时,已没有利用价值
d. 该实验说明化学研究对象复杂,反应受条件影响较大,因此应具体问题具体分析
(5)上述实验也反过来证明了“直接利用金属活动性顺序表判断原电池中的正负极”这种做法__填 “可靠”或“不可靠”)。如不可靠,请你提出另一个判断原电池正负极的可行实验方案_______________ (如 可靠,可不填)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】支撑海港码头基础的钢管桩,常用外加电流的阴极保护法进行防腐,工作原理如图所示,下列有关表述错误的是( )

A.利用了电解原理B.电子由电源负极流向钢管桩
C.钢管桩是负极D.高硅铸铁作阳极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在反应A(g)+3B(g)=2C(g)中,若以物质A表示的该反应的化学反应速率为0.2 mol·L1·min1,则以物质B表示此反应的化学反应速率为________mol·L1·min1。
(2)在2 L的密闭容器中,充入2 mol N2和3 mol H2,在一定条件下发生反应,3 s后测得N2为1.9 mol,则以H2的浓度变化表示的反应速率为____________________________。
(3)将10 mol A和5 mol B放入容积为10 L的密闭容器中,某温度下发生反应:3A(g)+B(g) ![]() 2C(g),在最初2 s内,消耗A的平均速率为0.06 mol·L1·s1,则在2 s时,容器中有______ mol A,此时C的物质的量浓度为________。
2C(g),在最初2 s内,消耗A的平均速率为0.06 mol·L1·s1,则在2 s时,容器中有______ mol A,此时C的物质的量浓度为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com