
据报道,一定条件下 Fe2O3可被甲烷还原为“纳米级”的金属铁。其反应为: Fe2O3(s)+3CH4(g)  2Fe(s)+3CO(g)+6H2(g)
2Fe(s)+3CO(g)+6H2(g)
(1)反应在5 L的密闭容器中进行,2 min 后达到平衡,测得 Fe2O3在反应中质量减少 4.8 g。则该段时间内H2的平均反应速率为______________;
(2)将固定质量的 Fe2O3(s)和 CH4(g)置于恒温恒压容器中,在一定条件下反应,能表明该反应达到平衡状态的是______________;
A.CH4的转化率等于 CO的产率
B.混合气体的平均相对分子质量不变
C.v 正(CO): v 逆(H2)=1 : 2
D.固体的总质量不变
(3)FeO 可用CO进行还原,已知:t℃时,FeO(s)+CO(g)  Fe(s)+CO2(g) K=0.5
Fe(s)+CO2(g) K=0.5
若在 1 L密闭容器中加入0.04 mol FeO(s),并通入 x mol CO,t℃时反应达到平衡。此时FeO(s)的转化率为 50%,则x=______________。
(4)在 3 L容积可变的密闭容器中发生反应:FeO(s)+CO(g)  Fe(s)+CO2(g),c(CO2)随反应时间t变化如图中曲线I所示。若在t0时刻分别改变一个条件, 曲线 I变为曲线II和曲线III。当曲线I变为曲线 II时,改变的条件是______________。当通过改变压强使曲线 I变为曲线III时,曲线 III达到平衡时容器的体积为_________L。
Fe(s)+CO2(g),c(CO2)随反应时间t变化如图中曲线I所示。若在t0时刻分别改变一个条件, 曲线 I变为曲线II和曲线III。当曲线I变为曲线 II时,改变的条件是______________。当通过改变压强使曲线 I变为曲线III时,曲线 III达到平衡时容器的体积为_________L。

科目:高中化学 来源:2015-2016学年山东济宁微山一中高二下第二次月考化学试卷(解析版) 题型:推断题
法国化学家V.Grignard,所发明的Grignard试剂(卤代烃基镁)广泛运用于有机合成。Grignard试剂的合成方法是:RX+Mg RMgX(Grignard试剂)。生成的卤代烃基镁与具有羰基结构的化合物(醛、酮等)发生反应,再水解就能合成各种指定结构的醇:
RMgX(Grignard试剂)。生成的卤代烃基镁与具有羰基结构的化合物(醛、酮等)发生反应,再水解就能合成各种指定结构的醇:

现以2-丁烯和必要的无机物为原料合成3,4-二甲基-3-己醇,进而合成一种分子式为C10H16O4的具有六元环的物质J,合成线路如下,H的一氯代物只有3种。

请按要求填空:
(1)F的结构简式是 ;
(2)C+D→E的反应类型是 ,F→G的反应类型是 ;
(3)写出下列化学反应方程式(有机物请用结构简式表示):
A→B , I→J 。
(4)I和该二元酸除了能反应生成J外,还可以在一定条件下发生缩聚反应生成高聚物,试写出此高聚物的结构简式 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二下期末化学试卷(解析版) 题型:推断题
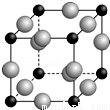
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大。其中基态A原子价电子排布式为nsnnpn+1;化合物B2E为离子化合物,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质常用于制作太阳能电池和集成电路芯片;F原子最外层电子数与B的相同,其余各内层轨道均充满电子。请根据以上信息,回答下列问题(用所对应的元素符号表示):
(1)A、B、E的第一电离能由小到大的顺序为 。
(2)氢化物A2H4分子中A原子采取 杂化。
(3)按原子的外围电子排布分区,元素F在 区,基态F原子的电子排布式为 。
(4)元素A和C可形成一种新型化合物材料,其晶体具有很高的硬度和熔点,其化合物中所含的化学键类型为 。
(5)A、F形成某种化合物的晶胞结构如下图所示(其中A显﹣3价,每个球均表示1个原子),则其化学式为 。设阿伏加德罗常数为NA,距离最近的两个F原子的核间距为a cm,则该晶胞的密度为(用含a和NA的代数式表示) g/cm3。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二下期末化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A.将铁粉加入FeCl3、CuCl2混合溶液中,充分反应后剩余的固体中必有铁
B.CO2和SO2混合气体分别通入BaCl2溶液、Ba(NO3)2溶液中,最终都有沉淀生成
C.钠、镁着火时,不可用泡沫灭火器灭火
D.用加热分解的方法可将NH4Cl固体和Ca(OH)2固体的混合物分离
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二下期末化学试卷(解析版) 题型:选择题
下列说法正确的是( )
①离子化合物一定含离子键,也可能含极性键或非极性键
②共价化合物一定含共价键,也可能含离子键
③含金属元素的化合物不一定是离子化合物
④由非金属元素组成的化合物一定是共价化合物
⑤由分子组成的物质中一定存在共价键
⑥熔融状态能导电的化合物一定是离子化合物
A.①③⑤ B.②④⑥ C.②③④ D.①③⑥
查看答案和解析>>
科目:高中化学 来源:2017届四川省新高三零诊模拟理综化学试卷(解析版) 题型:选择题
高铁酸盐在能源环保领域有广泛用途。用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示。下列推断合理的是 ( )
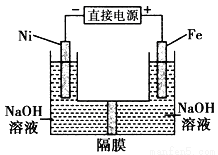
A.铁是阳极,电极反应为 Fe-6e一+4H2O=FeO42-+ 8H+
B.电解时电子的流动方向为:负极→Ni电极→溶液→Fe电极→正极
C.若隔膜为阴离子交换膜, 则电解结束后左侧溶液中含有FeO42-
D.电解时阳极区pH 降低、阴极区 pH升高,撤去隔膜混合后,与原溶液比较 pH升高(假设电解前后体积变化忽略不计)
查看答案和解析>>
科目:高中化学 来源:2017届四川省新高三零诊模拟理综化学试卷(解析版) 题型:选择题
在酸性介质中,往MnSO4溶液里滴加(NH4)2S2O8溶液会发生如下离子反应(未配平):Mn2+ +S2O82 一+H2O→ MnO4一+SO42 一+H+,下列说法不正确的是( )
A.氧化性比较:S2O82 一>MnO4一
B.氧化剂S2O82 一的摩尔质量为 192 g/mol
C.该反应中酸性介质可以为盐酸
D.若有0.1 mol氧化产物生成,则转移电子 0.5 mol
查看答案和解析>>
科目:高中化学 来源:2015-2016学年内蒙古高二实验班下期中化学卷(解析版) 题型:选择题
某芳香烃的分子式为C11H16,分子结构中只含有一个烷基,符合条件的烃有( )
A. 8种 B. 7种 C. 5种 D. 4种
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省高二下期末化学试卷(解析版) 题型:选择题
设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.0.1L,2mol/L的(NH4)2CO3溶液中含有CO32-数目为0.2NA
B.加热条件下,MnO2与浓盐酸反应生成7.1gCl2,转移的电子数目为0.2NA
C.标准状况下,11.2LCCl4中含有的分子数目为0.5NA
D.常温下,1L0.1mol•L-1的CH3COOH溶液中含有的H+数目为0.1NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com