

| Fe(OH)2 | Fe(OH)3 | Cr(OH)3 | |
| Ksp | 8.0×10-16 | 4.0×10-38 | 6.0×10-31 |
| 完全沉淀的pH | 9.0 | 3.2 | 5.6 |
分析 (1)Fe2+完全沉淀pH为9.0,Cr3+完全沉淀pH为5.6,要使溶液中Cr3+完全沉淀,且不引入杂质,要调节溶液pH介于二者之间即可;
(2)空气可以将部分Fe2+氧化成Fe3+,铁氧体悬浮物具有磁性,据此判断分离方法;
(3)将含+6价Cr的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解,阴极上水中的氢离子放电生成氢气,阳极上铁失去电子生成亚铁离子,根据电子得失守恒可计算出铁的质量.
解答 解:(1)Fe2+完全沉淀pH为9.0,Cr3+完全沉淀pH为5.6,要使溶液中Cr3+完全沉淀,且不引入杂质,要调节溶液pH介于二者之间即可,
故选B;
(2)空气可以将部分Fe2+氧化成Fe3+,所以控制空气适量的目的是使溶液中Fe2+与Fe3+的比例恰当,铁氧体悬浮物具有磁性,使铁氧体分离出来较简便的方法是用磁铁吸引,
故答案为:使溶液中Fe2+与Fe3+的比例恰当;用磁铁吸引;
(3)将含+6价Cr的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解,阴极上水中的氢离子放电生成氢气,阴极反应的电极方程式为2H2O+2e-═H2↑+2OH-,处理1×104 L含铬(+6价)78mg/L的废水,Cr2O72-发生反应,生成的Cr3+,电子转移的物质的量为$\frac{1×1{0}^{4}×78×1{0}^{-3}}{52}×3$mol=45mol,根据电子得失守恒可知,消耗的亚铁离子的物质的量为45mol,所以根据铁元素守恒,用去铁的质量为56×45g=2.52Kg,
故答案为:2H2O+2e-═H2↑+2OH-;2.52.
点评 本题考查了流程分析和电极反应式的书写,难度不大,注意(3)运用元素守恒和电子守恒是解题的关键.


 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子半径B>A>C | B. | 原子序数A>B>C | ||
| C. | 离子半径A2->B2+>C- | D. | 最外层电子数C>A>B |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气通入淀粉碘化钾溶液中,溶液变蓝,氧化性:Cl2>I2 | |
| B. | 久置的氯水最终变为稀盐酸 | |
| C. | NaClO溶液的漂白原理与Na202相同,与SO2不同 | |
| D. | 无色溶液C中加入AgN03溶液,产生白色沉淀,再加入稀盐酸,沉淀不消失,则无色溶液C中一定含有Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| pH范围 | >7 | <7 |
| 产物 | NO3- | NO、N2O、N2中的一种 |
| A. | 碱性条件下,NaNO2与NaClO反应的离子方程式为NO2-+ClO-═NO3-+Cl- | |
| B. | 向冷的NaNO2溶液中通入CO2可得到HNO2 | |
| C. | 向冷的NaNO2溶液中加入稀硫酸可得到HNO2 | |
| D. | 向冷的NaNO2溶液中加入滴有淀粉的氢碘酸,溶液变蓝色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 溶液中被沉淀的离子 | Fe3+ | Cu2+ |
| 完全生成氢氧化物沉淀时溶液的pH | ≥3.7 | ≥4.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
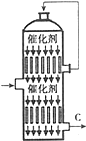 硫酸的年产量高低常用于衡量一个国家化工生产水平的高低.
硫酸的年产量高低常用于衡量一个国家化工生产水平的高低.| 压强 (Pa) 温度 (℃) | 1.013×105 | 5.065×105 | 10.13×105 | 15.195×105 |
| 400 | 99.61% | 99.72% | 99.84% | 99.88×105 |
| 500 | 96.75% | 97.67% | 98.52% | 98.94% |
| 600 | 85.20% | 88.97% | 92.76% | 94.68% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酒精灯内的酒精用量一般不超过其容积的$\frac{2}{3}$,也不少于其容积的$\frac{1}{4}$ | |
| B. | 用氢气还原氧化铜时,应先通入氢气一会儿,然后再点燃酒精灯加热 | |
| C. | 实验室用高锰酸钾制取氧气结束时,应先将导管从水中取出,然后再停止加热 | |
| D. | 在分液操作中,应将上层液体从分液漏斗的上口倒出 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com