
分析 (1)存在元素的化合价降低的物质为还原剂;氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性;
(2)反应中化合价升高的Cl元素失2个电子,化合价降低的Mn元素得到2个电子;
(3)①铜和稀硝酸反应生成硝酸铜、一氧化氮和水;
②放到铜粉和稀硫酸中,能实现铜粉溶解,所加物质在酸性条件下应具有强氧化性.
解答 解:(1)已知:①Cu+2Fe3+=Cu2++2Fe2+,Cu元素的化合价升高,则Cu为还原剂;氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性,则①中氧化性:Fe3+>Cu2+,②中氧化性:Cu2+>Fe2+,所以氧化性从强到弱的顺序是Fe3+>Cu2+>Fe2+;
故答案为:Cu;Fe3+>Cu2+>Fe2+;
(2)在反应MnO2+4HCI$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+C12↑+2H2O中,当生成1mol氯气时转移2mol电子,则有0.2mol电子转移时,产生氯气为0.1mol,其体积(标准状况)是2.24L;
故答案为:2.24L;
(3)①铜和稀硝酸反应生成硝酸铜、一氧化氮和水,反应的离子方程式为:3Cu+8H++2NO3-(稀)═3Cu2++2NO↑+4H2O,
故答案为:3Cu+8H++2NO3-(稀)═3Cu2++2NO↑+4H2O;
②放到铜粉和稀硫酸中,能实现铜粉溶解,所加物质在酸性条件下应具有强氧化性,题中KNO3和Cu(NO3)2符合,
故答案为:AC.
点评 本题考查氧化还原反应,侧重于概念的理解和计算,注意从元素化合价的角度认识氧化还原反应的相关概念和物质的性质,题目难度不大.


科目:高中化学 来源: 题型:实验题
| 编号 | A | B | C |
发 生 装 置 |  |  |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “绿色食品”“白色污染”“赤潮”都不仅仅与颜色有关 | |
| B. | 苯酚皂溶液可用于环境消毒,医用酒精可用于皮肤消毒,其原因均在于可使蛋白质变性凝固 | |
| C. | “酸可以除锈”“洗涤剂可以去油”都是发生了化学变化 | |
| D. | 区分植物油和矿物油的方法是加入足量的烧碱溶液共煮,不再分层的为植物油 |
查看答案和解析>>
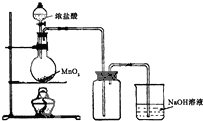
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3O4是还原剂 | B. | CO是氧化剂 | ||
| C. | 氧化剂得到6mol电子 | D. | 还原剂失去8mol电子 |
查看答案和解析>>
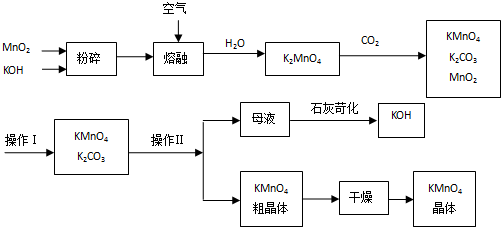
科目:高中化学 来源: 题型:实验题
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量 | 0.255g | 0.385g | 0.459g |
| 气体体积 | 280mL | 336mL | 336mL |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
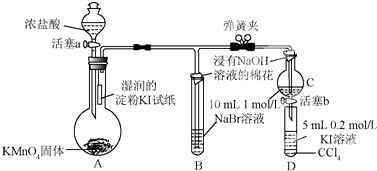
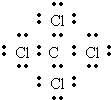 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com