
| A、①②④⑧ | B、③④⑤⑥ |
| C、③④⑥⑧ | D、①④⑤⑥⑦ |
| 1 |
| 10 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
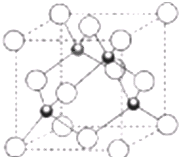 原子序数小于36的X、Y、Z、W四种元素,其中X是周期表中半径最小的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29.
原子序数小于36的X、Y、Z、W四种元素,其中X是周期表中半径最小的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含0.2NA个氮原子的氮气物质的量为0.1mol |
| B、标准状况下,18g水所具有的体积为22.4L |
| C、11.2L氦气所含的分子数目为0.5NA |
| D、1mol的NaCl溶解在1L的水中可以得到1mol/L的NaCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO2增多使太阳辐射到地球表面的能量增多 |
| B、植物的光合作用吸收了CO2 |
| C、CO2能放出能量,使地球变暖 |
| D、CO2、CH4等温室气体会吸收地球表面发出的长波辐射,减少地球的热量散失 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.3g钠与足量丙三醇反应,转移电子数为0.3×6.02×1023 |
| B、标准状况下,22.4L乙醇的共价键数为8×6.02×1023 |
| C、标准状况下,5.6L甲醛所含的电子数为4×6.02×1023 |
| D、100mL 1mol?L-1醋酸溶液中,H+的个数为0.1×6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在放电过程中,Ag2O为负极 |
| B、在放电过程中,电池负极区溶液pH减小 |
| C、在放电过程中,电子由Ag2O经外电路流向Zn |
| D、放电时,Ag2O电极发生氧化反应,Zn极发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、最外层有6个电子 |
| B、是非金属 |
| C、主要化合价为+2,+4价 |
| D、最高价氧化物有较强氧化性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com