
| A. | H2SO4 | B. | HCl | C. | HClO | D. | Ba(HSO3)2 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 它是${\;}_{8}^{16}$O2的同分异构体 | |
| B. | 它是O3的一种同素异形体 | |
| C. | ${\;}_{8}^{18}$O2与${\;}_{8}^{16}$O2互为同位素 | |
| D. | 1mol ${\;}_{8}^{18}$O2分子中含有20mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
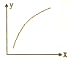 MgO可以通过下列反应制备:MgSO4(s)+CO(g)?MgO(s)+CO2(g)+SO2(g)△H>0,该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是( )
MgO可以通过下列反应制备:MgSO4(s)+CO(g)?MgO(s)+CO2(g)+SO2(g)△H>0,该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是( ) | 选项 | x | y |
| A | CO的物质的量 | CO与CO的物质的量之比 |
| B | SO的浓度 | 平衡常数K |
| C | 温度 | 容器内混合气体的密度 |
| D | CO的浓度 | CO的转化率 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 已知A、B、C、D、E、F、G、H、I为元素周期表中原子序数依次增大的前四周期元素,A原子的最外层中p轨道上的电子数等于前一电子层电子总数;A、B、C、D;E、F与G分别位于同一周期.C原子L层上有2对成电子,D、E、F的核外电子排布相同的简单离子可形成一种E3FD6型离子晶体X,EG、HC为电子数相同的离子晶体.I原子M层为全充满状态,且核外的未成对电子只有一个.请根据以上情况,回答下列问题:(答题时,用对应的元素符号表示)
已知A、B、C、D、E、F、G、H、I为元素周期表中原子序数依次增大的前四周期元素,A原子的最外层中p轨道上的电子数等于前一电子层电子总数;A、B、C、D;E、F与G分别位于同一周期.C原子L层上有2对成电子,D、E、F的核外电子排布相同的简单离子可形成一种E3FD6型离子晶体X,EG、HC为电子数相同的离子晶体.I原子M层为全充满状态,且核外的未成对电子只有一个.请根据以上情况,回答下列问题:(答题时,用对应的元素符号表示)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 饱和AgCl溶液与饱和Ag2CrO4溶液相比,前者的c(Ag+)大 | |
| B. | 向氯化银的浊液中加入氯化钠溶液,氯化银的Ksp减小 | |
| C. | 向0.0008mol/L的K2CrO4溶液中加入等体积的0.002mol/LAgNO3溶液,则CrO42-完全沉淀 | |
| D. | 将0.001mol/L的AgNO3溶液滴入0.001mol/L的KCl和0.001mol/L的K2CrO4溶液,则先产生AgCl沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com