
����Ŀ������������[CO(NH2)2��H2O2]��һ��Ư�ס���������������������Ϊ��ɫ���壬�������ˣ�һ�������²��ֽ⣬����30%��˫��ˮ�ͱ���������Һ��һ�����������ϳɡ�
ʵ��ԭ����CO(NH2)2��H2O2![]() CO(NH2)2��H2O2
CO(NH2)2��H2O2
ʵ��װ�ã�ʵ����ģ����ȡװ����ͼ1��ʾ(��������δ����)��
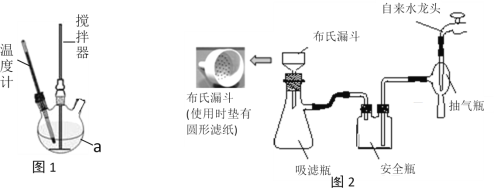
ʵ�鲽�裺
����һ����250mL������a�м���100mL30%�Ĺ���������Һ���ټ�1 g NaH2PO4���ȶ�����������������ͨ������a�Ҷ�ƿ�ڻ�������50 g���أ�ȫ���ܽ�����¶���30�����ң����跴Ӧ30���ӡ�
�������������a�е���Һ����ͨ©�����ˣ�����Һ��ȴ��0�棬�����������壬���ˣ���ɼ��ò�Ʒ��
�ش��������⣺
(1)����a ��������____________����ȡ�����������n(H2O2):n[CO(NH2)2] =1.2 :1���ң������ƺϳ��¶���30�����ң�����Ҫԭ����__________________________________�����Ʒ�Ӧ�¶ȵļ��ȷ�����________________��
(2)ʵ����һ���ò����������ʽ�������ԭ����____________________________________����ʵ�������н�����ѡ�õ������ʲ��ϣ����轫����װ�÷���__________________(���Լ�����)�н���һ��ʱ�䣬ʹ�����ۻ���
(3)�ٲ�����С����ˡ���ͼ2��װ��װ�ã��ڲ���©���з�����ֽ���������IJ���˳����____________________��ȷ�ϳ��(����)
a. ת�ƹ�Һ����� b. ����ˮ��ͷ c. ��ˮ��ͷ d. ������������ˮ��ʪ��ֽ
��������ͨ©��������ȣ����˵���Ҫ�ŵ���______________________________��
(4)���������ؼ�����Ӧ�����ظ����������Һ�м������Ѻ��������������أ����ϲ����ѳ���ɫ������������������Һ�й����������еĹ����������ظ���ط�Ӧ���ɽ��ȶ�����ɫ��������(CrO5��![]() )���ظ������H2O2��Ӧ�����ӷ���ʽΪ_______________��
)���ظ������H2O2��Ӧ�����ӷ���ʽΪ_______________��
(5)���������صĺϸ��Ʒ��H2O2 ����������Ӧ������34%��Ϊ��ȷ��ij��ʵ���Ʒ�ϸ����ȡ�˸ô���Ʒ12.0000g������ˮ���Ƴ�250mL��Һ����ȡ25.00mL��Һ����ƿ�У�����1mL 6mol��L�����ᣬȻ����0.2000 mol��L KMnO4����Һ�ζ������εζ�ƽ������KMnO4��Һ20.00mL(KMnO4��Һ�����ز���Ӧ)���յ���ɫ�仯Ϊ_____________�����ݵζ����ͨ�������жϸô�ʵ���Ʒ����Ϊ___________(�����ϸ����������ϸ���)��
���𰸡�������ƿ H2O2��ʵ������л��в��ַֽ⣬����H2O2��������߲�Ʒ�Ĵ��� ˮԡ���� H2O2��ˮ��Һ������Ӧ����Fe3�����ɴ��ӿ�H2O2�ֽ� Ũ����(��Ũ����) d��c��a��b �����ٶȸ��� 4H2O2��Cr2O![]() ��2H��===2CrO5��5H2O ��ɫ��dz��ɫ ���ϸ�
��2H��===2CrO5��5H2O ��ɫ��dz��ɫ ���ϸ�
��������
˫��ˮ�����ء��ȶ����ڷ�Ӧ���л�Ϸ�����Ӧ�õ����������شֲ�Ʒ��Ȼ��ͨ������Ũ������ȴ�ᾧ�����˵õ������ĸҺ��������ϴ�ӡ�����õ���Ʒ��
(1)����a��������������ƿ��˫��ˮ�������������¶ȸ�ʱ�ֽ⣻����ˮԡ���ȿ��Կ��Ʒ�Ӧ�¶ȣ�
(2)˫��ˮ������Ӧ���������ӣ�����������˫��ˮ�ֽ�Ĵ���������Ũ�����Ũ����ۻ���
(3)���ݳ��˵IJ����������ѡ��
(4)������Ŀ��������Ϣд�����ӷ���ʽ��
(5)����2MnO4��5H2O2��6H����2Mn2����8H2O��5O2��������������ʵ���������������������������������
˫��ˮ�����ء��ȶ����ڷ�Ӧ���л�Ϸ�����Ӧ�õ����������شֲ�Ʒ��Ȼ��ͨ������Ũ������ȴ�ᾧ�����˵õ������ĸҺ��������ϴ�ӡ�����õ���Ʒ��
(1)����a��������������ƿ����ȡ�����������n(H2O2):n[CO(NH2)2] =1.2��1���ң�ԭ����H2O2��ʵ������л��в��ַֽ⣬����H2O2��������߲�Ʒ�Ĵ��ȣ�����ˮԡ���ȿ��Կ��Ʒ�Ӧ�¶ȣ�
(2)˫��ˮ������Ӧ���������ӣ�����������˫��ˮ�ֽ�Ĵ�����Ϊ��ֹ˫��ˮ�ֽ⣬���Բ�����Fe������������Ũ�����Ũ����ۻ������轫����װ�÷���Ũ�����Ũ�����н���һ��ʱ�䣻
(3)�ٸ��ݳ��˵IJ��������֪���ڲ���©���з�����ֽ������������ˮ��ʪ��ֽ����ˮ��ͷ��ת�ƹ�Һ��������ˮ��ͷ��ȷ�ϳ�ɣ����Բ�������d��c��a��b��
��������ͨ©��������ȣ����˵���Ҫ�ŵ��ǹ����ٶȸ��죻
(4)��������Һ�й����������еĹ����������ظ���ط�Ӧ���ɽ��ȶ�����ɫ��������CrO5�����ӷ���ʽΪ��4H2O2��Cr2O72-��2H��=2CrO5��5H2O��
(5)��ȡ������Ʒ12.000g���ܽ⣬��250mL����ƿ�ж���,ȷ��ȡ25.00mL����ƿ�У�����1mL 6mol/L�����ᣬȻ����0.2000mol/L KMnO4����Һ�ζ�������������ӱ���ԭΪ��ɫ�������ӣ������������Һ�������һ��ʱ����Һ��ɫ��dz��ɫ�Ұ�����ڲ���ɫ���ﵽ�ζ��յ㣻���εζ�ƽ������KMnO4��Һ20.00mL�����ݷ�Ӧ2MnO4��5H2O2��6H����2Mn2����8H2O��5O2��
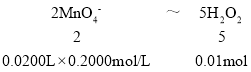
250mL����ƿ�к���������0.1mol��������������������![]() ��100%��28.3%<34%���ʸô�ʵ���Ʒ�������ϸ�
��100%��28.3%<34%���ʸô�ʵ���Ʒ�������ϸ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������Ӽ���ķ�����ȷ���ǣ� ��
A.ij��Һ�м���������Һ���ɰ�ɫ������˵��ԭ��Һ����![]()
B.ij��Һ�м�![]() ��Һ���ɰ�ɫ������˵��ԭ��Һ����
��Һ���ɰ�ɫ������˵��ԭ��Һ����![]()
C.ij��Һ�м�NaOH��Һ������ɫ������˵��ԭ��Һ����![]()
D.ij��Һ�м�ϡ������Һ������ɫ��ζ���壬˵��ԭ��Һ����![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʯ(��Ҫ����SrSO4������CaCO3����)�ǻ�ȡ��Ԫ�صĸ��ֻ��������Ҫԭ�ϡ���ش��������⣺
(1)������ɫ��Ӧ���Զ��Լ���ijЩ�����Ρ�����SrSO4ʱ���ȵ���ɫΪ_____(����)�� A�����ɫ B��dz��ɫ C������ɫ D������ɫ
(2)����(SrS)����������Ϳ�ϵ�ԭ�ϣ�SrSO4��̼�Ļ�Ϸ�ĩ�ڸ��������¸��±��տ��������Ⱥ�һ�ֻ�ԭ�����壬 �÷�Ӧ�Ļ�ѧ����ʽ____________________________��
(3)��֪��25��ʱ��K sp(SrSO4)=3.2��10-7��K sp(SrCO3)=1.1��10-10��SrSO4�ķ�ĩ��Na2CO3��Һ��ϼ��ȡ���ֽ�������������ƺ�̼���ȣ���ת�����ʱ�ָ���25�棬���Һ��c(CO![]() )=1.0��10-3mol/L����c(SO
)=1.0��10-3mol/L����c(SO![]() )=______________________��
)=______________________��
(4)������ʯ����Sr(OH)2��xH2O�Ĺ������£�

��֪�� Sr(OH)2 ��Ca(OH)2��ˮ�е��ܽ�����±���
�¶�/(��) | 0 | 20 | 40 | 60 | 80 | 100 | |
�ܽ��(g) | Sr(OH)2 | 0.91 | 1.77 | 3.95 | 8.42 | 20.2 | 91.2 |
Ca(OH)2 | 0.19 | 0.17 | 0.14 | 0.12 | 0.09 | 0.08 | |
������2Ϊ����CaCO3��SrCO3��д����Ӧ1����SrCO3�Ļ�ѧ����ʽ______________��
�ڹ���3 ������ˮ������Ϊ�˻�ýϴ�����Sr(OH)2��Һ/span>,��ʱӦ��������ʹ������������,����5����Ҫ�ɷ���______(�ѧʽ),�����ȹ�������Ŀ����_________________________________��
�ۡ�����6����Ҫ�У�________________�����ˡ�ϴ�ӡ����
��ȡm g����Sr(OH)2��x H2O��Ʒ����ˮ���������Na2CO3��Һ����ˡ�ϴ�ӡ�����õ�n g��������x=__________(�ú�m��n��ʽ�ӱ�ʾ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������Ȼ����Ļ����Һ����μ�������������Һ����������������������Һ����������ó��������ʵ����Ĺ�ϵ��ͼ��ʾ��
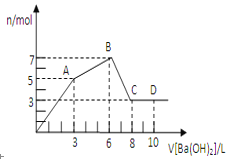
��1������������ҺŨ��Ϊ_____________________��
��2��ԭ�����Һ��SO42-��Cl-�����ʵ���֮��Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ij�Ͻ��ĩ�������⣬����������ͭ�е�һ�ֻ����֣�ij��ȤС������ʦ��ָ���£��ԺϽ�������ͭ�Ĵ����������������̽����
���������ϣ�����ͭ��������������Һ��Ӧ��
�����룩����1���úϽ��ĩ�У��������⣬����������
����2���úϽ��ĩ�У��������⣬������ͭ��
����3���úϽ��ĩ�У��������⣬������_________�������ƣ���
��ʵ��̽��������ʵ�����ѡ����Լ��ǣ�10%�����ᡢ30%������������Һ��
ʵ�鷽�� | ʵ������ | ���� |
��ȡһ�����ĺϽ��ĩ���ӹ�����____����ַ�Ӧ����ˣ��������á� | ��ĩ�����ܽ⣬��������ų��� | �Ͻ���һ���������� |
��ȡ����������������ӹ�����______����ַ�Ӧ�� | ������ĩ�����ܽ⣬��������ų�����Һ����dz��ɫ�� | �Ͻ���һ������______�� |
��̽�����ۣ�����3������
����˼��һ����˵�����ý�������������ᷴӦ���������ᡢ��ܷ�Ӧ��˵����������������ʡ�д����������������Һ��Ӧ�����ӷ���ʽ__________��
��֪ʶ���죩��һ�������£�������������ˮ��Ӧ��д������Ӧ�����£�����ˮ������Ӧ�Ļ�ѧ����ʽ_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Y������(��ͨ��)X��Һ�����ɳ������������X�����ʵ�����ϵ��ͼ��ʾ���±��з���ͼʾ�������
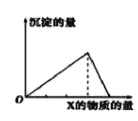
A | B | C | D | |
X | CO2 | HCl | NaOH | AlCl3 |
Y | Ca(OH)2 | NaAlO2 | AlCl3 | NaOH |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ij��Ԫ��H2MO4��ˮ�е��������������H2MO4H++HMO4-��HMO4-H++MO42-����������20 mL0.1mol/L NaHMO4��Һ�е���cmol/LNaOH��Һ����Һ�¶������NaOH��Һ�����ϵ��ͼ������˵����ȷ����

A.������������ҺpH=12
B.ͼ����F���Ӧ����Һ��c(OH-)>c(HMO4-)
C.����NaOH��Һ������ˮ�ĵ���̶�һֱ����
D.ͼ����G���Ӧ����Һ��c(Na+)=c(HMO4-)+2c(MO42-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ��ˮϵп���ӵ���ܷ�ӦʽΪxZn+Zn1-xMn2O4![]() ZnMn2O4.(0<x<1)������˵��������ǣ� ��
ZnMn2O4.(0<x<1)������˵��������ǣ� ��
A.���ʱ�������ĵ缫��ӦʽΪZn1-xMn2O4+xZn2++2xe-=ZnMn2O4
B.�ŵ�ʱ��Zn2+������Ǩ��
C.��ŵ������п���̵Ļ��ϼ۶������仯
D.�ŵ�ʱ��ÿת��1mole-������������32.5g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij������Һ�п��ܺ���Na+��K+��NH4+��Mg2+��Fe2+��SO42����SO32����Cl����I����CO32���е������֣�������Ũ�ȶ���ȡ���ȡ����Һ�����й�ʵ�飬ʵ��������ͼ��ʾ��
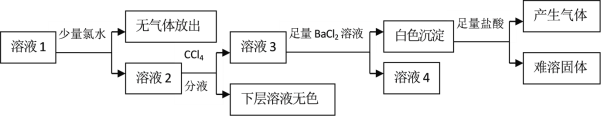
���й��ڸ���Һ��˵������ȷ����
A.ͨ��CCl4����ɫ������֪ԭ��Һ��һ��������I-
B.���ɫ�����м�������������岢�������ܹ������֪ԭ��Һ�д���SO32����CO32-
C.����Һ�в�����ͬʱ����NH4+��Cl-
D.��ȡ����Һ��������ŨNaOH��Һ�����ȣ����Թܿڵ�ʪ���ɫʯ����ֽ�����������ȷ��ԭ��Һ���������ӵĴ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com