
研究表明,在CuZnO催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO,反应的热化学方程式如下:
CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H1 平衡常数K1 反应Ⅰ
CH3OH(g)+H2O(g)△H1 平衡常数K1 反应Ⅰ
CO2(g)+H2(g) CO(g)+H2O(g)△H2 =+41.2kJ•mol-8平衡常数K2 反应Ⅱ
CO(g)+H2O(g)△H2 =+41.2kJ•mol-8平衡常数K2 反应Ⅱ
某实验室控制CO2和H2初始投料比为1:2.2,在相同压强下,经过相同反应时间测得如下实验数据:
T(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
543 | Cat.1 | 12.3 | 42.3 |
543 | Cat.2 | 10.9 | 72.7 |
553 | Cat.1 | 15.3 | 39.1 |
553 | Cat.2 | 12.0 | 71.6 |
[备注]Cat.1:Cu/ZnO纳米棒;Cat.2:Cu/ZnO纳米片;甲醇选择性;转化的CO2中生成甲醇的百分比
(1)合成的甲醇可用于燃料电池的燃料,若电解质为稀烧碱溶液时甲醇燃料电池的正极反应式为________;研究证实,CO2也可在酸性水溶液中通过电解生成甲醇,则生成甲醇的反应发生在______极,该电极反应式是________________________________。
(2)从表中实验数据可以分析出,提高CO2转化成CH3OH的选择性的方法有______________。
(3)反应CO(g)+2H2(g) CH3OH(g)的平衡常数K3=____________(用K1和K2表示)。
CH3OH(g)的平衡常数K3=____________(用K1和K2表示)。
(4)在恒压密闭容器中,由CO2和H2进行反应I合成甲醇,在其它条件不变的情况下,探究温度对化学平衡的影响,实验结果如图。
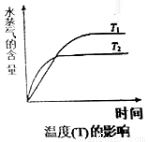
①△H1_________0(填“>”、“<”或“=”)
②有利于提高CO2平衡转化率的措施有___________(填标号)。
A.降低反应温度
B.投料比不变,增加反应物的浓度
C.增大CO2和H2的初始投料比
D.混合气体中掺入一定量惰性气体(不参与反应)
(5)在T1温度时,将1.00molCO2和3.00molH2充入体积为1.00L的恒容密闭容器中,容器起始压强为P0,仅进行反应I。
①充分反应达到平衡后,若CO2转化率为a,则容器的压强与起始压强之比为________(用a表示)。
②若经过3h反应达到平衡,平衡后,混合气体物质的量为3.00mol,则该过程中H2的平均反应速率为____________(保留三位有效数字);该温度下反应的化学平衡常数K为____________(保留三位有效数字);平衡常数K可用反应体系中气体物质分压表示,即K表达式中用平衡分压代替平衡浓度,分压=总压×物质的量分数。写出上述反应压力平衡常数KP为____________(用P0表示,并化简)。
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源:2015-2016学年新疆伊犁州伊宁二中高二下期末化学试卷(解析版) 题型:选择题
元素X、Y、Z在周期表中的相对位置如图所示。已知Y元素原子的外围电子排布为ns(n-1)np(n+1),则下列说法不正确的是( )
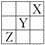
A. Y元素原子的外围电子排布为4s24p4
B. Y元素在周期表的第三周期ⅥA族
C. X元素所在周期中所含非金属元素最多
D. Z元素原子的核外电子排布式为1s22s22p63s23p63d104s24p3
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省华蓥市高一下期末化学试卷(解析版) 题型:选择题
下列关于化学键的说法不正确的是 ( )
A.并不是所有物质都含有化学键
B.只有非金属原子间才能形成共价键
C.单质不可能含有离子键
D.共价化合物中不可能含有离子键
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省华蓥市高二下期末化学试卷(解析版) 题型:选择题
某可逆反应为2X(g)  3Y(g)+Z(g),混合气体中X的物质的量分数与温度关系如图所示:
3Y(g)+Z(g),混合气体中X的物质的量分数与温度关系如图所示:
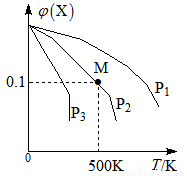
下列推断正确的是
A.升高温度,该反应平衡常数K减小
B.压强大小为:P3>P2>P1
C.平衡后加入高效催化剂使Mr增大
D.在该条件下M点X平衡转化率为
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省华蓥市高二下期末化学试卷(解析版) 题型:选择题
常温下下列各组离子在指定溶液中能大量共存的是
A.pH=1的溶液中:Fe2+、NO3-、SO42-、Na+
B.由水电离出的c(H+)=1×10-14mol/L的溶液中:Ca2+、Cl-、HCO3-、K+
C.c(H+)/c(OH-)=1×1012的溶液中:NH4+、Cl-、NO3-、Al3+
D.c(Fe3+)=0.1 mol/L的溶液中:K+、ClO-、SO42—、SCN-
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江省高二下期末化学试卷(解析版) 题型:选择题
COCl2的分解反应为COCl2(g) Cl2(g)+CO(g)。将一定量COCl2(g)和Cl2(g)放入一密闭容器中,2min时达到平衡后,各物质的物质的量在不同条件下的变化情况如下图所示。
Cl2(g)+CO(g)。将一定量COCl2(g)和Cl2(g)放入一密闭容器中,2min时达到平衡后,各物质的物质的量在不同条件下的变化情况如下图所示。
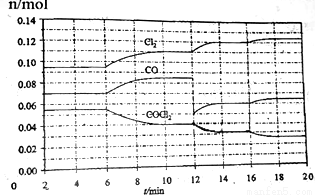
下列相关说法中不正确的是
A.1min时以CO表示的逆反应速率小于3min时以CO表示的正反应速率
B.若在6min时改变的条件为升高温度,则反应的平衡常数K增大
C.12min时改变的条件可为减小CO的浓度,16min时改变的条件可为增大反应容器的体积
D.以CO表示在4~5min、10~11min和12~13min时平均反应速率为v(4~5)<v(10~11)<v(12~13)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江省高二下期末化学试卷(解析版) 题型:选择题
锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过。下列有关叙述不正确的是
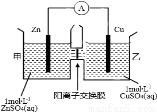
A.Zn电极上发生氧化反应
B.电子的流向为Zn→电流表→Cu
C.SO42-由乙池通过离子交换膜向甲池移动
D.电池工作一段时间后,乙池溶液的总质量明显增加
查看答案和解析>>
科目:高中化学 来源:2015-2016学年内蒙古高一下期末化学试卷(解析版) 题型:填空题
(1)将6gCH3COOH溶于水制成lL溶液,此溶液的物质的量浓度为_______,经测定溶液中含CH3COO-为1.4×10-3mol/L,此温度下醋酸的电离常数:Ka=_____,温度升高,电离平衡______(填“正向”、“逆向”或“不”)移动,Ka将_______。
(2)在a、b两支试管中,分别装入足量Na2CO3粉末,然后向两支试管中分别加入相同物质的量浓度、相同体积的稀盐酸和稀醋酸。填写下列空白。
a、b 两支试管中生成气体的速率开始时是a_____b,反应完毕后生成气体的总体积是a_____b ,原因是_________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南省等三校高一下期末化学试卷(解析版) 题型:选择题
在用Zn片、Cu片和稀硫酸组成的电池装置中,下列说法中正确的是
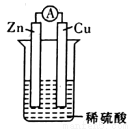
A.锌片是正极,铜片上有气泡产生
B.电流方向是从锌片流向铜片
C.溶液中的阳离子向正极移动,阴离子向负极移动
D.经过一段时问工作后'电解液的pH值减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com