
在水中加入等物质的量的Ag+、Pb2+、Na+、SO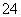 、NO
、NO 、Cl-,该溶液放在用惰性电极材料作电极的电解槽中,通电片刻,则氧化产物与还原产物质量比为( )
、Cl-,该溶液放在用惰性电极材料作电极的电解槽中,通电片刻,则氧化产物与还原产物质量比为( )
A.35.5∶108 B.16∶207
C.8∶1 D.108∶35.5
科目:高中化学 来源: 题型:
石墨烯(图甲)是一种由单层碳原子构成的平面结构新型碳材料,石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯(图乙)。
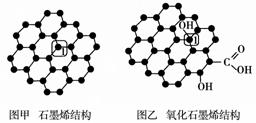
(1)图甲中,1号C与相邻C形成σ键的个数为________。
(2)图乙中,1号C的杂化方式是________,该C与相邻C形成的键角________(填“>”“<”或“=”)图甲中1号C与相邻C形成的键角。
(3)若将图乙所示的氧化石墨烯分散在H2O中,则氧化石墨烯中可与H2O形成氢键的原子有________(填元素符号)。
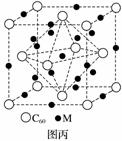
(4)石墨烯可转化为富勒烯(C60),某金属M与C60可制备一种低温超导材料,晶胞如图丙所示,M原子位于晶胞的棱上与内部。该晶胞中M原子的个数为________,该材料的化学式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
X是第3周期非金属元素,该原子如果要达到8电子稳定结构,需要的电子数小于其次外层和最内层的电子数之差,且等于最内层电子数的整数倍。下列说法正确的是( )
A.X最高价氧化物对应的水化物一定是强酸
B.X元素的氢化物化学式一定为H2X
C.X的单质一定是良好的半导体材料
D.X元素的氧化物一定能与烧碱反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于常见有机物的说法正确的是( )
A.乙炔的化学性质与乙烯的相似,也能形成高分子化合物
B.甲烷是水煤气的主要成分
C.不粘锅的原料 为烃类化合物
为烃类化合物
D.葡萄糖、鸡蛋清均能与NaOH溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
向一定量的Fe、FeO和Fe2O3的混合物中加入120 mL 4 mol·L-1的稀硝酸,恰好使混合物完全溶解,放出1.344 L NO(标准状况),向所得溶液中加入KSCN溶液,无血红色出现。若用足量的氢气在加热条件下还原相同质量的混合物能得到铁的物质的量为( )
A.0.21 mol B.0.24 mol
C.0.16 mol D.0.14 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
将3.6 g铁铜混合粉末,投入100 mL c mol·L-1的稀硝酸中,金属粉末与硝酸恰好完全反应(还原产物只有NO),向反应后的溶液中加入足量的NaOH溶液,充分反应后将沉淀过滤、洗涤、灼烧至恒重后称量为4.8 g。则c值不可能为( )
A.1.2 B.1.75 C.2.3 D.1.95
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学兴趣小组的同学学习了同周期元素性质递变规律后,设计了一套实验方案进行实验探究,并记录了有关实验现象如下表:
| 实验操作 | 实验现象 |
| Ⅰ.用砂纸打磨后的镁带与沸水反应,再向反应后溶液中滴加酚酞 Ⅱ.向新制的H2S饱和溶液中滴加新制的氯水 Ⅲ.钠与滴有酚酞溶液的冷水反应 Ⅳ.镁带与2 mol·L-1的盐酸反应 Ⅴ.铝条与2 mol·L-1的盐酸反应 Ⅵ.向AlCl3溶液滴加NaOH溶液至过量 | A.浮于水面,熔成一个小球,在水面上无定向 移动,随之消失,溶液变红色 B.产生气体,可在空气中燃烧,溶液变成浅红 色 C.反应不十分强烈,产生的气体可以在空气中 燃烧 D.剧烈反应,产生可燃性气体 E.生成白色胶状沉淀,进而沉淀消失 F.生成淡黄色沉淀 |
请你帮助该同学整理并完成实验报告
(1)实验目的:___________________________________________________。
(2)实验用品:仪器①______________、②____________、③____________、④试管夹、⑤镊子、⑥小刀、⑦玻璃片、⑧砂纸、⑨胶头滴管等。
药品:钠、镁带、铝条、2 mol·L-1的盐酸、新制的氯水、新制的饱和H2S溶液、AlCl3溶液、NaOH溶液等。
(3)请你写出上述的实验操作与对应的现象
Ⅰ________、Ⅱ________、Ⅲ________、Ⅳ________、Ⅴ________、Ⅵ________。(用A~F表示)
写出实验操作Ⅱ、Ⅵ的离子反应方程式
实验Ⅱ________________________________________________________________________;
实验Ⅵ________________________________________________________________________。
(4)实验结论:___________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
有A、B、C、D、E五块金属片,进行如下实验:①A、B用导线相连后,同时浸入稀H2SO4溶液中,A极为负极;②C、D用导线相连后,同时浸入稀H2SO4溶液中,电流由D→导线→C;③A、C相连后,同时浸入稀H2SO4溶液中,C极产生大量气泡;④B、D相连后,同时浸入稀H2SO4溶液中,D极发生氧化反应;⑤用惰性电极电解含B离子和E离子的溶液,E先析出。据此,判断五种金属的活动性顺序是( )
A.A>B>C>D>E B.A>C>D>B>E
C.C>A>B>D>E D.B>D>C>A>E
查看答案和解析>>
科目:高中化学 来源: 题型:
全钒液流电池是一种活性物质呈循环流动液态的电池,目前钒电池技术已经趋近成熟。下图是钒电池基本工作原理示意图:
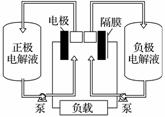
请回答下列问题:
(1)硫酸在电池技术和实验室中具有广泛的应用,在传统的铜锌原电池中,硫酸是____________,实验室中配制硫酸亚铁时需要加入少量硫酸,硫酸的作用是____。
(2)钒电池是以溶解于一定浓度硫酸溶液中的不同价态的钒离子(V2+、V3+、VO2+、VO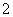 )为正极和负极电极反应的活性物质,电池总反应为VO2++V3++H2O
)为正极和负极电极反应的活性物质,电池总反应为VO2++V3++H2O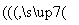 V2++VO
V2++VO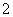 +2H+。放电时的正极___________________________________________________________________,
+2H+。放电时的正极___________________________________________________________________,
充电时的阴极反应式为___________________________________________________________。放电过程中,电解液的pH________(填“升高”、“降低”或“不变”)。
(3)钒电池基本工作原理示意图中“正极电解液”可能是________(填字母)。
a.VO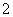 、VO2+混合液 b.V3+、V2+混合液
、VO2+混合液 b.V3+、V2+混合液
c.VO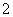 溶液 d.VO2+溶液
溶液 d.VO2+溶液
e.V3+溶液 f.V2+溶液
(4)能够通过钒电池基本工作原理示意图中“隔膜”的离子是________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com