
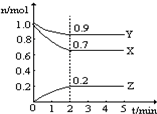
 某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.据此回答:
某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.据此回答:分析 ①根据物质的量的变化判断反应物和生成物,根据物质的量的变化之比等于化学计量数之比书写方程式;
②根据c=$\frac{△c}{△t}$计算反应速率;
③影响化学反应速率的因素有浓度、温度、压强、催化剂以及固体表面积、溶剂等因素,以此解答该题.
解答 解:①由图象可以看出,反应中X、Y的物质的量减小,Z的物质的量增多,则X、Y为反应物,Z为生成物,且△n(X):△n(Y):△n(Z)=0.3mol:0.1mol:0.2mol=3:1:2,则反应的化学方程式为:3X+Y?2Z,
故答案为:3X+Y?2Z;
②反应开始至2min时Z的平均反应速率为:c(Z)=$\frac{\frac{0.2mol}{2L}}{2min}$=0.05mol/(L•min),
故答案为:0.05;
③A、升高温度,速率加快,故正确;
B、减小物质X的物质的量,速率减慢,故错误;
C、减小压强,速率减慢,故错误;
D、增加物质Z的物质的量,速率加快,故正确;
E、加入某种催化剂,速率加快,故正确;
故选ADE.
点评 本题考查化学方程式的判断以及反应速率的计算、影响反应速率的因素知识,题目难度不大,注意图象题目中曲线的变化特点.


科目:高中化学 来源: 题型:选择题
| A. | 可燃冰是一种天然气的水合物,它的开采使用有助于解决温室效应 | |
| B. | 天然食品添加剂比化学合成品安全可靠 | |
| C. | 有一种新发现的固态碳,称为“纳米泡沫”,外形似海绵,密度小,有磁性,这种碳与金刚石的关系是同素异形体 | |
| D. | 工业酒精含95%左右的乙醇,可以用于酒精饮料的勾兑,降低生产成本 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液态HCl不导电,所以HCl不是电解质 | |
| B. | BaSO4在水中难导电,但熔融状态下能导电,所以BaSO4是电解质 | |
| C. | SO2溶于水能导电,所以SO2是电解质 | |
| D. | NH3溶于水形成的溶液能导电,所以NH3是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
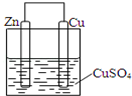 某同学设计的原电池如图所示,回答下列问题:
某同学设计的原电池如图所示,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一组 | B. | 两组 | C. | 三组 | D. | 四组 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
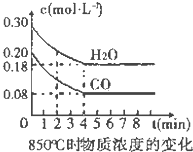 在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:
在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


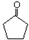 ,G中官能团的名称为碳碳双键、酯基.
,G中官能团的名称为碳碳双键、酯基. ,反应类型加成反应.
,反应类型加成反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 病人输液用的葡萄糖注射液是葡萄糖(C6H12O6)的水溶液,其标签上的部分内容如图所示.利用标签所提供的信息,回答下列问题:
病人输液用的葡萄糖注射液是葡萄糖(C6H12O6)的水溶液,其标签上的部分内容如图所示.利用标签所提供的信息,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com