
【题目】碳族元素的单质及其化合物是一类重要物质。请回答下列问题:
(1)锗(Ge)是用途很广的半导体材料,基态Ge原子的核外电子中,有_____个未成对电子。
(2)Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键。从原子结构角度分析,原因是________________________________________。
(3)GeCl4可水解生成一种氧化物和一种无氧酸,其化学反应方程式为:_______________。
(4)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是____________________。
(5)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为______,微粒之间存在的作用力是_______。
(6)合成氮化碳是一种硬度比金刚石还大的晶体,氮化碳的晶体类型为________,该晶体中微粒间的作用力是____________。
(7)COCl2俗称光气,分子中C原子采取sp2杂化成键,光气分子的结构式为____________,其中碳氧原子之间共价键是________(填序号)。
a.2个σ键b.2个π键c.1个σ键,1个π键
(8) CaC2中C22与O22+互为等电子体,O22+的电子式可表示为________。
【答案】2 Ge原子半径大,原子间形成的σ单键较长,p-p轨道肩并肩重叠程度很小或几乎不能重叠,难以形成π键; GeCl4+2H2O=4HCl+GeO2 O>Ge>Zn sp3 共价键 原子晶体 共价键  c
c ![]()
【解析】
(1)Ge是32号元素,位于第四周期第IVA族,基态Ge原子核外电子排布式为[Ar]3d104s24p2;
(2)Ge原子半径大,难以通过“肩并肩”方式形成π键;
(3)GeCl4可水解生成HCl和GeO2;
(4)元素的非金属性越强,吸引电子的能力越强,元素的电负性越大;
(5)Ge单晶具有金刚石型结构,Ge原子与周围4个Ge原子形成正四面体结构,向空间延伸的立体网状结构,属于原子晶体;
(6) 根据物理性质判断晶体类型,根据非金属原子间形成共价键分析;
(7) COCl2俗称光气,分子中C原子采取sp2杂化成键,C原子与氯原子之间形成C-Cl单键,故C原子与O原子之间形成C=O双键,双键中含有1个σ键、1个π键;
(8) 等电子体的结构相似,故O22+的电子式与C22-的电子式相似,含有2个π键。
(1)Ge是32号元素,位于第四周期第IVA族,基态Ge原子核外电子排布式为1s22s22p63s23p63d104s24p2或[Ar]3d104s24p2,在最外层的4s能级上2个电子为成对电子,4p轨道中2个电子分别处以不同的轨道内,有2轨道未成对电子;
(2)虽然Ge与C是同族元素,C原子之间可以形成双键、叁键,但考虑Ge原子半径大,原子间形成的σ单键较长,p-p轨道肩并肩重叠程度很小或几乎不能重叠,难以形成π键,所以Ge原子之间难以形成双键或叁键;
(3)GeCl4可水解生成一种氧化物和一种无氧酸,其化学反应方程式为:GeCl4+2H2O=4HCl+GeO2;
(4)元素非金属性:Zn<Ge<O,元素的非金属性越强,吸引电子的能力越强,元素的电负性越大,故电负性:O>Ge>Zn;
(5)Ge单晶具有金刚石型结构,Ge原子与周围4个Ge原子形成正四面体结构,向空间延伸的立体网状结构,属于原子晶体,Ge原子之间形成共价键,Ge原子杂化轨道数目为4,采取sp3杂化;
(6)氮化碳是一种硬度比金刚石还大的晶体材料,则氮化碳具有原子晶体的性质,所以属于原子晶体;非金属原子间形成共价键,所以N与C之间形成共价键;
(7)COCl2俗称光气,分子中C原子采取sp2杂化成键,C原子与氯原子之间形成CCl单键,故C原子与O原子之间形成C=O双键,光气分子的结构式是![]() ,C=O双键中含有1个σ键、1个π键,答案选c;
,C=O双键中含有1个σ键、1个π键,答案选c;
(8)根据等电子体的结构相似,O22+的电子式与C22的电子式相似,含有2个π键,O22+的电子式![]() 。
。


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
【题目】用已知物质的量浓度的HCl来测定未知物质的量浓度的NaOH溶液时,选甲基橙作指示剂,使所测氢氧化钠溶液的浓度偏低的是( )
A.锥形瓶用蒸馏水冲洗后未用待测液润洗
B.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
C.终点时,有一滴标准液挂在滴定管尖嘴处未滴入锥形瓶
D.装标准液的滴定管滴定前尖嘴处有气泡,滴定后气泡消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是
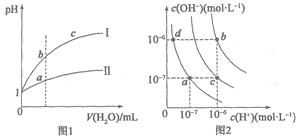
A.图1表示相同温度下pH=1的盐酸和醋酸溶液分别加水稀释时pH的变化曲线,其中曲线II为盐酸,且b点溶液的导电性比a点强
B.图1中,中和等体积的两种酸,消耗等浓度的NaOH溶液体积V(I)>V(II)
C.图2中纯水仅升高温度,就可以从a点变到c点
D.图2中在b点对应温度下,将pH=2的H2SO4与pH=10的NaOH溶液等体积混合后,溶液显中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海带中提取碘,可经过以下实验步骤完成。下列有关说法正确的是( )

A.灼烧过程中使用的玻璃仪器有酒精灯、烧杯、玻璃棒
B.氧化过程中发生反应的离子方程式为![]()
C.检验碘单质时,可选用淀粉,若淀粉变蓝说明海带中一定含有碘单质
D.分液时,先打开活塞放出下层液体,再关闭活塞,从上口倒出上层液体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在室温下,下列五种溶液:①0.1 mol/L NH4Cl溶液,②0.1 mol/L CH3COONH4溶液,③0.1 mol/L NH4HSO4溶液,④0.1 mol/L 氨水,⑤0.1 mol/L NH3·H2O和0.1 mol/L NH4Cl混合液(显碱性)。请根据要求填写下列空白:
(1)溶液①呈____________性(填“酸”、“碱”或“中”),其原因是___________(用离子方程式表示)
(2)在上述①、②、③、④溶液中c(NH4+)浓度由大到小的顺序是_________。(填序号)
(3)在溶液⑤中,各离子浓度大小顺序为___________。
(4)室温下,测得溶液②的pH=7,则 CH3COO—与NH4+浓度的大小关系是c(CH3COO—)________c(NH4+)(填“>”、“<”或“=”)。
(5)常温下,0.1 mol/ L CH3COOH溶液加水稀释过程中,下列表达式的数值变大的是____________(填字母)。
A. c(H+) B. c(H+)/ c(CH3COOH) C. c(H+)·c(OH-)
D. c(OH-)/ c(H+) E. c(H+)·c(CH3COO-) / c(CH3COOH)
(6)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、R、W均为周期表中前四周期的元素.X的基态原子外围电子排布式为3s2;Y原子的L电子层的p能级上有一个空轨道;Z元素的基态原子最外层有3个未成对电子,次外层有2个电子;M的原子的2p轨道上有1个电子的自旋方向与其它电子的自旋方向相反;R是海水中除氢、氧元素外含量最多的元素;W为过渡元素,它的基态原子外围电子排布成对电子数和未成对电子数相同且为最外层电子数的两倍.回答下列问题(相关回答均用元素符号表示):
(1)W的基态原子的外围电子排布图为__,其基态原子有__种能量不同的电子。
(2)R的氢化物的沸点比其上一周期同族元素氢化物的沸点低的原因是__。
(3)ZM3-空间构型为___,其中Z的杂化方式为__。
(4)W与YM易形成配合物W(YM)5,在W(YM)5中W的化合价为___;与YM分子互为等电子体的离子的化学式为___。
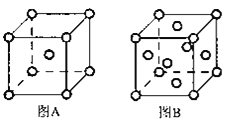
(5)W单质的晶体在不同温度下有两种原子堆积方式,晶胞分别如图A、B所示:图B中原子堆积方式为___,A、B中W原子的配位数之比为___。A、B晶胞的棱长分别为acm和bcm,则A、B两种晶体的密度之比为___。
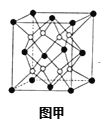
(6)X和W组成的合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图甲(黑球代表W,白球代表X).则该合金的化学式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有机物F和高分子N的合成路线如图所示:
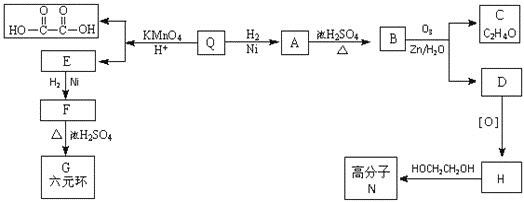
已知:RCH=CHR'![]() RCOOH+R'COOH,RCH=CHR'
RCOOH+R'COOH,RCH=CHR'![]() RCHO+R'CHO
RCHO+R'CHO
![]() 只含碳、氢、氧三种元素,且其碳、氢、氧元素质量比为
只含碳、氢、氧三种元素,且其碳、氢、氧元素质量比为![]() ,经测定Q的相对分子质量是128。
,经测定Q的相对分子质量是128。![]() 可与
可与![]() 加成,并能与
加成,并能与![]() 恰好完全反应,且分子中无支链。Q的分子式是 ______________。
恰好完全反应,且分子中无支链。Q的分子式是 ______________。
![]() 所含官能团的名称是 ___________、 _____________;
所含官能团的名称是 ___________、 _____________;![]() 的反应类型是 ________________;
的反应类型是 ________________;
![]() 写出C与银氨溶液反应的化学方程式: _______________;
写出C与银氨溶液反应的化学方程式: _______________;
![]() 的结构简式是 _______________;Q的反式结构简式是 ____________。
的结构简式是 _______________;Q的反式结构简式是 ____________。
![]() 下列说法正确的是 _________________。
下列说法正确的是 _________________。
A. C能与苯酚在一定条件下生成高分子化合物
B. D催化加氢的产物与F互为同分异构体
C. F能发生氧化反应、取代反应、加成反应
D. 高分子N的每条分子链中含有![]() 个酯基
个酯基
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常见有机物间的转化关系如图所示(以下变化中,某些反应条件及产物未标明)。A是天然有机高分子化合物,D是一种重要的化工原料。在相同条件下,G蒸气密度是氢气的44倍。
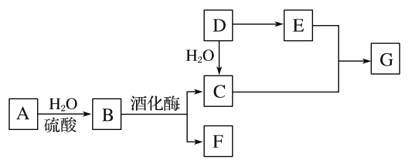
(1)D中官能团的名称:______________________________________。
(2)C和E反应的化学方程式:________________________。
(3)检验A转化过程中有B生成,先中和水解液,再需要加入的试剂是________________________________。
(4)某烃X的相对分子质量是D、F之和,分子中碳与氢的质量之比是5∶1。下列说法正确的是________(填字母)。
A.X 不溶于水,与甲烷互为同系物
B.X性质稳定,高温下不会分解
C.X不存在含有3个甲基的同分异构体
D.X可能和溴水发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CoCl2可用于电镀,是一种性能优越的电池前驱材料,由含钴矿(Co元素主要以Co2O3、CoO存在,还含有Fe、Si、Cu、Zn、Mn、Ni、Mg、Ca元素)制取氯化钴晶体的一种工艺流程如下:
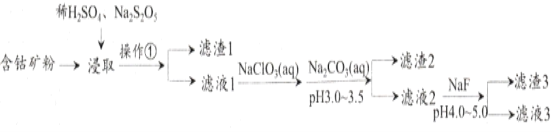
已知:①焦亚硫酸钠Na2S2O5,常做食品抗氧化剂。CaF2、MgF2难溶于水。
②CoCl2·6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110—120℃时,失去结晶水变成有毒的无水氯化钴。
③部分金属离子形成氢氧化物的pH见下表:
Co3+ | Fe3+ | Cu2+ | Co2+ | Fe2+ | Zn2+ | Mn2+ | Mg2+ | |
开始沉淀pH | 0.3 | 2.7 | 5.5 | 7.2 | 7.6 | 7.6 | 8.3 | 9.6 |
完全沉淀pH | 1.1 | 3.2 | 6.6 | 9.2 | 9.6 | 9.2 | 9.3 | 11.1 |
回答下列问题:
(1)操作①的名称为_________,NaClO3具有氧化性,其名称为__________________。
(2)浸取中加入Na2S2O5的作用是___________________________。
(3)滤液1中加入NaClO3/span>的作用是_______________________________________,相关的离子方程式为__________________________________________。
(4)加入Na2CO3溶液生成滤渣2的主要离子方程式为___________________________。
(5)滤渣3主要成分为________________________(写化学式)。
滤液3经过多次萃取与反萃取制备CoCl2晶体
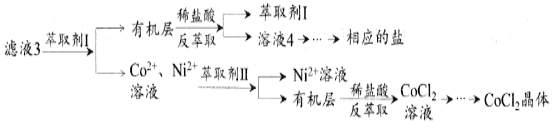
(6)滤液3中加入萃取剂I,然后用稀盐酸反萃取的目的是_______________________。
(7)制备晶体CoCl2·6H2O,需在减压环境下烘干的原因是_________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com