
【题目】Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定。

Ⅰ.制备Na2S2O3·5H2O
反应原理:Na2SO3(aq)+S(s)![]() Na2S2O3(aq)
Na2S2O3(aq)
实验步骤:
①称取15 g Na2SO3加入圆底烧瓶中,再加入80 mL蒸馏水。另取5 g研细的硫粉,用3 mL乙醇润湿,加入上述溶液中。
②安装实验装置(如图所示,部分夹持装置略去),水浴加热,微沸60 min。
③趁热过滤,将滤液水浴加热浓缩,冷却析出Na2S2O3·5H2O,经过滤、洗涤、干燥,得到产品。
回答问题:
(1)硫粉在反应前用乙醇润湿的目的是__________________________。
(2)仪器a的名称是________,其作用是____________________。
(3)产品中除了有未反应的Na2SO3外,最可能存在的无机杂质是______________。检验是否存在该杂质的方法是___________________________。
(4)该实验一般控制在碱性环境下进行,否则产品发黄,用离子反应方程式表示其原因:____________。
Ⅱ.测定产品纯度
准确称取W g产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.100 0 mol·L-1碘的标准溶液滴定。
反应原理为2S2O32—+I2===S4O62—+2I-
(5)滴定至终点时,溶液颜色的变化:____________________________________________。
(6)滴定起始和终点的液面位置如图,则消耗碘的标准溶液体积为__________mL。产品的纯度为(设Na2S2O3·5H2O相对分子质量为M)______________。

Ⅲ.Na2S2O3的应用
(7)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO42—,常用作脱氯剂,该反应的离子方程式为____________。
【答案】使硫粉易于分散到溶液中 冷凝管 冷凝回流 Na2SO4 取少量产品溶于过量盐酸,过滤,向滤液中加BaCl2溶液,若有白色沉淀,则产品中含有Na2SO4 S2O32-+2H+===S↓+SO2↑+H2O 由无色变蓝色 18.10 ![]() ×100% S2O32-+4Cl2+5H2O===2SO42-+8Cl-+10H+
×100% S2O32-+4Cl2+5H2O===2SO42-+8Cl-+10H+
【解析】
(1)硫粉难溶于水,微溶于乙醇,故硫粉用乙醇润湿后易扩散到溶液中;(2)装置中仪器a是冷凝管,起冷凝回流汽化的反应物的作用;(3)因反应物Na2SO3易被空气中的氧气氧化成Na2SO4,故可能存在的无机杂质是Na2SO4;检验产品中是否含有Na2SO4,即检验SO42-是否存在,需要防止SO32-的干扰,故不能用具有强氧化性的硝酸酸化,而应用盐酸酸化,过滤除去不溶物,再向滤液中滴加氯化钡溶液, 故答案为取少量产品溶于过量盐酸,过滤,向滤液中加BaCl2溶液,若有白色沉淀,则产品中含有Na2SO4;(4)产品发黄,说明产品中含有硫杂质,这是由于在酸性环境中Na2S2O3不稳定,发生歧化反应:2H++S2O32-==S↓+SO2↑+H2O所致;(5)滴定终点时,过量的单质碘使无色的淀粉溶液变蓝,可指示滴定终点;(6)起始读数为0.00 mL,终点读数为18.10 mL,所以消耗碘的标准溶液的体积为18.10 mL-0.00 mL=18.10 mL;根据2Na2S2O3·5H2O~2S2O32-~I2,得n(Na2S2O3·5H2O) =2n(I2)=2×0.100 0 mol·L-1×18.10×10-3 L=3.620×10-3 mol,则产品的纯度![]() ×100%=
×100%=![]() ×100%。(7)S2O32-被Cl2氧化成SO42-,Cl2被还原为Cl-,首先根据化合价升降总数相等写出S2O32-+4Cl2→2SO42-+8Cl-,然后根据原子守恒和电荷守恒写出S2O32-+4Cl2+5H2O===2SO42-+8Cl-+10H+。
×100%。(7)S2O32-被Cl2氧化成SO42-,Cl2被还原为Cl-,首先根据化合价升降总数相等写出S2O32-+4Cl2→2SO42-+8Cl-,然后根据原子守恒和电荷守恒写出S2O32-+4Cl2+5H2O===2SO42-+8Cl-+10H+。


 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:
【题目】已知2-丁烯有顺、反两种异构体,在其条件下可种气体处于平衡,

 (g)+H2(g)→CH3CH2CH2CH3(g) △H=-118.9kJ/mol;
(g)+H2(g)→CH3CH2CH2CH3(g) △H=-118.9kJ/mol;
下列说法正确的是
A. 顺-2-丁烯比反-2-丁烯稳定
B. 加压和降温有利于平衡向生成顺-2- 丁烯反应方向移动
C. .顺-2-丁烯的燃烧热比反-2-丁烯小
D. 反-2-丁烯氢化的热化学方程式为 (g)+H2(g)→CH3CH2CH2CH3(g) △H=-114.7kJ/mol
(g)+H2(g)→CH3CH2CH2CH3(g) △H=-114.7kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】泡的是山茶,品的是心性,茶的这一生,后来只凝结成一抹犹之未尽的留香于齿。其中泡茶的过程(投茶、注水、出汤、斟茶)中属于过滤操作的是( )
A.投茶B.注水C.出汤D.斟茶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工业粗盐水中含有Ca2+、NH4+等杂质,可用下列方法去除(部分产物、步骤略去):
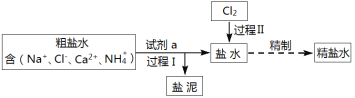
请回答下列问题:
(1)过程I中,除去粗盐水中Ca2+需加入的试剂a是______。
(2)盐泥的成分是_______。
(3)实验室由MnO2与浓盐酸混合加热制取Cl2的化学方程式是_______。
(4)若1 mol MnO2完全反应,在标准状况下生成Cl2的体积是_______L。
(5)过程II中,在碱性条件下Cl2将NH4+氧化为N2而除去,其离子方程式是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是 ( )
A. 向水中通入氯气:Cl2+H2O![]() 2H++Cl-+ClO-
2H++Cl-+ClO-
B. 向氯化铁溶液中加入铜:2Fe3++3Cu===2Fe+3Cu2+
C. NH4HCO3溶液与过量KOH浓溶液共热:NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
D. 向二氧化锰中滴加浓盐酸并加热:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将金属钠投入饱和MgCl2溶液中,下列现象合理的是
A.开始时,钠浮在液面上、四处游动并熔成小球
B.反应结束后,在溶液底部有银白色金属产生
C.反应结束后,在溶液中无沉淀生成
D.反应结束后,在溶液底部析出黑色固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求进行计算,直接写出结果
(1)标准状况下,2.24 L CH4所含氢原子的物质的量为____mol。
(2)含0.2 mol氧原子的NO2的质量是____g。
(3)100 mL 0.5mol· L-1 H2SO4溶液中,H+的物质的量浓度为____mol· L-1。
(4)1mol碳在一定量氧气中反应,生成气体的质量为36 g。所得气体的物质的量为____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在碱性溶液中,下列各项中的离子可以大量共存的是
A. Fe3+、Cu2+ 、Cl-、NO3- B. K+、NO3-、Ag+、Cl-
C. Na+、SO42-、K+、Cl- D. Ca2+、MnO4-、Na+、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将m1g铜铝合金投入到1 L含H2SO4和HNO3的混合溶液中,合金完全溶解后只生成VL —氧化氮气体(标准状况),向反应后的溶液中逐滴加入1mol/L NaOH溶液,生成沉淀的质量与所加NaOH溶液的体积的关系如下图所示。下列说法中不正确的是:

A. 2c(H2SO4) + c(HNO3) = 0.8 mol·L-1
B. m2—m1=5.1
C. 原合金中铝的质量分数为34.7%
D. V = 2.24
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com