
【题目】25℃时,CH3COONH4显中性.
Ⅰ.将0.1mol/L的CH3COOH溶液与0.1mol/L的NaOH溶液等体积混合(混合后溶液的体积变化忽略不计)测得混合溶液的pH=9.回答下列问题:
(1)用离子方程式表示混合溶液的pH=9的原因: .
(2)混合溶液中c(CH3COOH)=mol/L(列式,不必化简).
(3)相同温度相同浓度的下列四种溶液:①(NH4)2CO3②CH3COONH4③(NH4)2SO4④NH4Cl,pH由大到小的顺序为:(填序号).
Ⅱ.Mg(OH)2沉淀可溶于NH4Cl溶液.同学们对有关该反应的原理的解释如下:甲同学认为是NH4Cl水解,溶液呈酸性,H+中和了Mg(OH)2电离出的OH﹣导致沉淀溶解;乙同学认为是NH4+与Mg(OH)2电离出的OH﹣反应生成弱电解质NH3H2O导致沉淀溶解.
(4)丙同学不能肯定哪位同学的解释合理,于是选用下列一种试剂来验证甲、乙两同学的观点,他选用的试剂是:
A.NH4NO3
B.CH3COONH4
C.Na2CO3
D.NH3H2O
(5)丙同学将所选试剂滴加到Mg(OH)2的悬浊液中,Mg(OH)2溶解,由此可知:(填“甲”或“乙”)的解释更为合理.Mg(OH)2沉淀与NH4Cl反应的离子方程式为: .
(6)现有Mg(OH)2和Al(OH)3沉淀的混合物,若要除去Al(OH)3得到纯净的Mg(OH)2 , 可用;若要除去Mg(OH)2得到纯净的Al(OH)3 , 可用;(写化学式)
【答案】
(1)CH3COO﹣+H2O?CH3COOH+OH﹣
(2)(1×10﹣5﹣1×10﹣9)
(3)①②④③
(4)B
(5)乙;Mg(OH)2+2 NH4+═Mg2++2NH3?H2O
(6)NH4NO3(或CH3COONH4等铵盐均可);NaOH溶液等
【解析】解:(1)等物质的量的醋酸和NaOH恰好完全反应生成醋酸钠,溶液呈碱性,说明醋酸是弱酸,醋酸根离子水解导致溶液呈碱性,水解方程式为CH3COO﹣+H2OCH3COOH+OH﹣ , 所以答案是:CH3COO﹣+H2OCH3COOH+OH﹣;(2)根据电荷守恒得c(CH3COO﹣)+c(OH﹣)=c(Na+)+c(H+),
根据物料守恒得c(Na+)=c(CH3COOH)+c(CH3COO﹣),
所以得c(CH3COOH)=c(OH﹣)﹣c(H+)= ![]() mol/L﹣10﹣9mol/L=(1×10﹣5﹣1×10﹣9)mol/L,
mol/L﹣10﹣9mol/L=(1×10﹣5﹣1×10﹣9)mol/L,
所以答案是:(1×10﹣5﹣1×10﹣9);(3)CH3COONH4溶液呈中性,说明CH3COO﹣水解程度和NH4+水解程度相同;CO32﹣水解程度大于CH3COO﹣ , 所以①溶液呈碱性;
②溶液呈中性;
③④中NH4+水解程度相同,两种溶液都呈酸性,但④中NH4+浓度大,所以pH③<④,
通过以上分析知,溶液pH大小顺序是①②④③,
所以答案是:①②④③;(4)硝酸铵和氯化铵相似,只有铵根离子的水解,而碳酸钠和氨水溶液都呈碱性,只有B符合,
所以答案是:B;(5)丙同学将所选试剂滴加到Mg(OH)2悬浊液中,Mg(OH)2溶解,说明氢氧化镁和铵根离子反应而使氢氧化镁溶解,离子方程式为Mg(OH)2+2 NH4+═Mg2++2NH3H2O,
所以答案是:乙;Mg(OH)2+2 NH4+═Mg2++2NH3H2O;(6)通过以上分析知,氢氧化镁溶于铵盐,但氢氧化不溶于铵盐,可以用铵盐除去氢氧化镁,如NH4NO3(或CH3COONH4等铵盐均可);氢氧化铝能溶于强碱,但氢氧化镁不溶于强碱,所以可以用强碱溶液除去氢氧化铝,如NaOH溶液等,
所以答案是:NH4NO3(或CH3COONH4等铵盐均可);NaOH溶液等.


科目:高中化学 来源: 题型:
【题目】根据所学知识回答下列问题
(1)以K、Na、H、O、S、N中任两种或三种元素组成合适物质,分别填在表中②、④、⑥后面。
物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
化学式 | ①H2SO4 ②_______ | ③NaOH ④_______ | ⑤Na2SO4 ⑥_______ | ⑦CO2 ⑧SO3 | ⑨NH3 |
(2)写出①与少量的③溶液反应的离子方程式__________________________。
(3)写出铁与①溶液反应的化学方程式________________________________。
(4)某同学欲用10mol·L-1浓硫酸配制480 mL 1 mol·L-1的稀硫酸。配制480mL 1mol·L-1的稀硫酸需要用量筒量取上述浓硫酸的体积为_________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2C2O4(草酸)是一种无色晶体,易溶于水,熔点为182℃,150~160℃升华,189.5℃分解。25℃时,Ka1=6×10-2,Ka2=6.4×10-5,Ksp(CaC2O4)=4.0×10-9。某校甲、乙、丙3个学习小组设计实验探究草酸的化学性质。
(1)草酸中所含官能团的名称为__________;
反应Ca2+(aq)+H2C2O4(aq)![]() CaC2O4(s)+2H+(aq),25℃时的平衡常数K=__________。
CaC2O4(s)+2H+(aq),25℃时的平衡常数K=__________。
(2)甲组同学在Na2CO3溶液中加入少量草酸溶液产生大量气体,他们查得H2CO3的Ka1=4.47×10-7,Ka2=4.68×10-11,则发生反应的离子方程式为______________。
(3)乙组同学在酸性KMnO4溶液中逐滴加入草酸溶液,溶液紫色逐渐褪去,说明草酸具有_____性,反应中氧化产物与还原产物的物质的量之比为_________。
(4)丙组同学设计下列装置分解H2C2O4并设计实验装置检验产物中的CO2和CO。
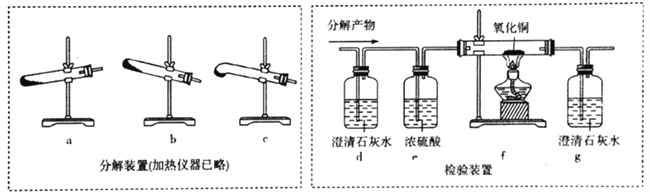 ①分解H2C2O4装置中最好的是__________(填字母)。
①分解H2C2O4装置中最好的是__________(填字母)。
②d中澄清石灰水变浑浊,能否说明有CO2生成? ___(填“能“或“不能”,下同),理由是________;仅依据装置g中澄清石灰水变浑浊,能否说明有CO生成?_________,理由是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中含有丰富的镁资源.某同学设计了从模拟海水中制备MgO的实验方案: 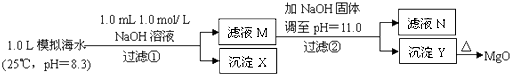
模拟海水中的 | Na+ | Mg2+ | Ca2+ | Cl﹣ | HCO3﹣ |
0.439 | 0.050 | 0.011 | 0.560 | 0.001 |
注:溶液中某种离子的浓度小于1.0×10﹣5 mol/L,可认为该离子不存在;实验过程中,假设溶液体积不变.已知:Ksp(CaCO3)=4.96×10﹣9;Ksp(MgCO3)=6.82×10﹣6;Ksp[Ca(OH)2]=4.68×10﹣6;Ksp[Mg(OH)2]=5.61×10﹣12 . 下列说法正确的是( )
A.沉淀物X为CaCO3
B.滤液M中存在Mg2+ , 不存在Ca2+
C.滤液N中存在Mg2+、Ca2+
D.步骤②中若改为加入4.2gNaOH固体,沉淀物Y为Ca(OH)2和Mg(OH)2的混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.1 mol镁和铝的混合物溶于100 mL 2 mol/L 稀硫酸中,然后滴加1 mol/L的NaOH溶液。若在滴加NaOH溶液的过程中,沉淀质量随加入NaOH溶液体积的变化如图所示,下列说法正确的是
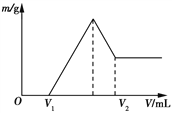
A. 当V1=150 mL时,金属粉末中镁粉的质量分数为50%
B. 若在滴加NaOH溶液的过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH)=400mL。
C. 若其中镁粉的物质的量分数为a,用100 mL 2 mol/L稀硫酸溶解此混合物后,再加入450 mL 1 mol/L NaOH溶液,所得沉淀中无Al(OH)3,则a的取值范围为![]() <a<1
<a<1
D. 若在滴加NaOH溶液的体积为V2时,溶液中溶质为NaAlO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,满足表中图示物质在一定条件下一步转化关系的组合有
序号 | X | Y | Z | W |
|
① | Si | Na2SiO3 | H2SiO3 | SiO2 | |
② | Na | NaOH | Na2CO3 | NaCl | |
③ | Cl2 | Ca(ClO)2 | HClO | HCl | |
④ | Fe | FeCl3 | FeCl2 | Fe(OH)2 |
A. ①②③ B. ①③④ C. ②③ D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( ) 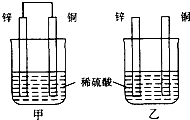
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的pH均减小
D.产生气泡的速度甲比乙快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中能够区别SO2和CO2的是( )
①石灰水 ②H2S溶液 ③KMnO4溶液 ④氯水 ⑤品红溶液
A. ①②③ B. ②③④ C. 除①以外 D. 全部
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com