
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
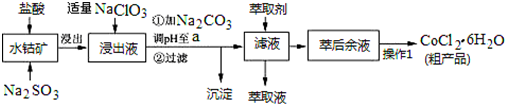
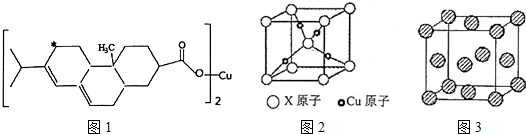
分析 含钴废料中加入盐酸和亚硫酸钠,Co2O3、Co(OH)3、Fe2O3、Al2O3、MnO和稀盐酸反应生成可溶性的CoCl2、AlCl3、FeCl2、MnCl2、NaCl,然后向溶液中加入氯酸钠,可得到FeCl3,然后加入Na2CO3调pH值,得到沉淀和溶液,根据滤液中得到的物质知溶液中Fe 3+、Al 3+完全转化为沉淀,则可得到Fe(OH)3、Al(OH)3沉淀,根据离子沉淀所需pH值知,需要溶液的pH=5.2;然后过滤,向滤液中加入萃取剂,将锰离子萃取,萃取后的溶液中主要含有CoCl2,为得到CoCl2•6H2O晶体,将溶液蒸发浓缩、冷却结晶而得到粗产品,
(1)向水钴矿加入盐酸和亚硫酸钠,浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等,所以氧化钴和亚硫酸钠在酸性条件下发生氧化还原,根据电荷守恒和得失电子守恒书写方程式;
(2)加入氯酸钠,+2价Fe被氧化生成+3价Fe,氯酸钠中氯元素的化合价由+5价变为-1价,得到电子,方程式为:ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O,不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,因为氯酸根离子和氯离子反应生成氯气;
(3)加入碳酸钠调节pH目的是将铁离子和铝离子转化为沉淀,根据表中数据知,条件溶液的pH=5.2;
(4)制得的CoCl2•6H2O在高温下分解失去结晶水;
(5)根据流程图可知,此时溶液中还存在锰离子和钴离子,由萃取剂将这两种离子除去才能得到较纯净的产物CoCl2;
(6)根据CoCl2•6H2O的组成分析,造成产品中CoCl2•6H2O的质量分数大于100%的原因可能是含有杂质,且杂质中含有氯离子,会晶体失去部分水.
解答 解:含钴废料中加入盐酸和亚硫酸钠,Co2O3、Co(OH)3、Fe2O3、Al2O3、MnO和稀盐酸反应生成可溶性的CoCl2、AlCl3、FeCl2、MnCl2、NaCl,然后向溶液中加入氯酸钠,可得到FeCl3,然后加入Na2CO3调pH值,得到沉淀和溶液,根据滤液中得到的物质知溶液中Fe 3+、Al 3+完全转化为沉淀,则可得到Fe(OH)3、Al(OH)3沉淀,根据离子沉淀所需pH值知,需要溶液的pH=5.2;然后过滤,向滤液中加入萃取剂,将锰离子萃取,萃取后的溶液中主要含有CoCl2,为得到CoCl2•6H2O晶体,将溶液蒸发浓缩、冷却结晶而得到粗产品,
(1)向水钴矿加入盐酸和亚硫酸钠,浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等,所以氧化钴和亚硫酸钠在酸性条件下发生氧化还原,根据电荷守恒和得失电子守恒,反应为Co2O3+SO32-+4H+=2Co2++SO42-+2H2O,
故答案为:Co2O3+SO32-+4H+=2Co2++SO42-+2H2O;
(2)加入氯酸钠,会将+2价Fe氧化为+3价Fe,氯酸钠中氯元素的化合价由+5价变为-1价,该反应方程式为:ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O,不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,说明氯酸根离子和氯离子反应生成氯气,方程式为:ClO3-+5Cl-+6H+=3Cl2↑+3H2O,
故答案为:ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;
(3)加入碳酸钠调节pH,目的是将铁离子和铝离子完全转化为沉淀,根据表中数据知,pH=5.2,铝离子能与碳酸根离子发生双水解生成氢氧化铝和二氧化碳,铁离子和碳酸根离子发生双水解生成氢氧化铁和二氧化碳,所以生成的沉淀为:Fe(OH)3、Al(OH)3,
故答案为:Fe(OH)3、Al(OH)3;
(4)制得的CoCl2•6H2O在高温下分解失去结晶水,所以在烘干时需减压烘干的原因是降低烘干温度,防止产品分解,
故答案为:降低烘干温度,防止产品分解;
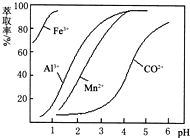
(5)根据流程图可知,此时溶液中还存在锰离子和钴离子,由萃取剂对金属离子的萃取率和pH的关系可知,调节溶液的pH在3.0-3.5之间,可使锰离子完全沉淀,并防止钴离子转化为氢氧化钴沉淀,
故答案为:除去溶液中的Mn2+;B;
(6)根据CoCl2•6H2O的组成分析,造成产品中CoCl2•6H2O的质量分数大于100%的原因可能是含有杂质,杂质中含有氯元素,或晶体失去了部分结晶水,这些因素导致氯元素含量增大,
故答案为:粗产品含有可溶性氯化物或晶体失去了部分结晶水.
点评 本题考查物质的分离和提纯,侧重考查学生分析判断能力,涉及氧化还原反应、离子反应、pH与沉淀的关系等知识点,为高频考点,明确流程图中发生的反应及基本操作是解本题关键,难点是图2的分析判断,题目难度中等.


 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:选择题
| A | B | C | D |
| 将氨水滴到氯化铝溶液中至过量 | 将二氧化碳逐渐通入氯水中至过量 | 将铜粉加入到浓硝酸中至过量 | 卤族元素的氧化物沸点随核电荷数的变化 |
 |  |  |  |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强/kPa | 5.7 | p1 | 12.0 | p2 | 24.0 |
| 平衡气体总浓度/10-3mol•L-1 | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
| A. | 混合气体的平均相对分子质量$\overline{M}$不再随时间变化的反应达到平衡状态 | |
| B. | 15.0℃时NH2COONH4(s)分解的平衡常数为2.0×10-9(mol/L)3 | |
| C. | 该反应△H>0,p2=2p1 | |
| D. | 若在恒温下将平衡体系体积减半,再达平衡后,c(NH3)和c(CO2)均比原平衡大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生物质能来源于植物及其加工产品所存贮的能量,绿色植物通过光合作用将化学能转化成生物质能 | |
| B. | 2015年8月国内油价再次迎来成品油最高零售价的下调,上演了年内首场“四连跌”,但油品从国Ⅳ汽油升级到Ⅴ汽油,有助于减少酸雨、雾霾,提高空气质量 | |
| C. | 我国已能利用3D打印技术,以钛合金粉末为原料,通过激光熔化逐层堆积,来制造飞机钛合金结构件,高温下可用金属钠还原四氯化钛来制取金属钛 | |
| D. | 元素分析仪可以确定物质中是否含有C、H、O、N、S、Cl、Br等元素,原子吸收光谱可以确定物质中含有哪些金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol酸与1mol碱完全反应放出的热量就是中和热 | |
| B. | 如果反应在加热时才能发生,则该反应是吸热反应 | |
| C. | 反应物总能量大于生成物总能量,则反应的△H<0 | |
| D. | 强酸强碱中和热的离子方程式可表示为:H+(aq)+OH-(aq)═H2O(l)△H=57.3 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
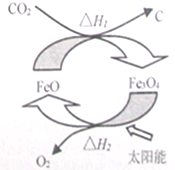
| A. | 由二氧化碳制取碳和氧气的反应为放热反应 | |
| B. | 该循环反应中,FeO的质量减小 | |
| C. | 根据盖斯定律可知,△H1+△H2=0 | |
| D. | 该反应是将太阳能转化为化学能 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com