
����Ŀ��ij��ѧʵ��С���ͬѧΪ̽���ͱȽ�SO2����ˮ��Ư���ԣ���������µ�ʵ��װ�ã� 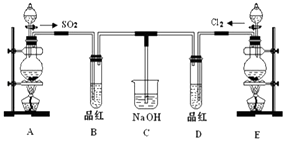
��1��ʵ������װ��A�Ʊ�SO2 �� ijͬѧ��ʵ��ʱ���ִ�A�ķ�Һ©��������©����Һ��δ���£�����Ϊԭ������� ��
��2��ʵ������װ��E�Ʊ�Cl2 �� �䷴Ӧ�����ӷ���ʽΪ������6mol��HCl�μӷ�Ӧ����ת�Ƶĵ�������Ϊ ��
��3��ֹͣͨ�����ٸ�B��D�����Թֱܷ���ȣ������Թ��е�����ֱ�ΪB�� �� D�� ��
��4����һ��ʵ��С���ͬѧ��ΪSO2����ˮ����Ư���ԣ�����Ϻ��Ư���Կ϶����ǿ�����ǽ��Ƶõ�SO2��Cl2��1��1ͬʱͨ�뵽Ʒ����Һ�У����������ɫЧ���������������������������������ԭ���û�ѧ����ʽ��ʾ�� ��
���𰸡�
��1����Һ©���IJ�����û��ȡ����
��2��MnO2+4H++2Cl�� ![]() Mn2++2H2O+Cl2����3��6.02��1023
Mn2++2H2O+Cl2����3��6.02��1023
��3����ɫ��Ʒ���ָֻ��ɺ�ɫ����Һû�����Ա仯
��4��SO2+Cl2+2H2O=H2SO4+2HCl
���������⣺��1������û��ȡ����������ʱ�������������Һ©���ڲ�����ɷ�Һ©���ڵ�ѹǿС�ڴ���ѹǿ��Һ�����������ʴ�Ϊ����Һ©���IJ�����û��ȡ��������2��ʵ������װ��E�Ʊ�Cl2 �� ����ȣ�Ϊ�������̺�Ũ����ķ�Ӧ������������ѧ��ӦΪMnO2+4HCl��Ũ�� ![]() MnCl2+Cl2��+2H2O�����ӷ�ӦΪ��MnO2+4H++2Cl��
MnCl2+Cl2��+2H2O�����ӷ�ӦΪ��MnO2+4H++2Cl�� ![]() Mn2++2H2O+Cl2������MnO2+4HCl��Ũ��
Mn2++2H2O+Cl2������MnO2+4HCl��Ũ�� ![]() MnCl2+Cl2��+2H2O��ÿ��4mol HCl���뷴Ӧ�����������Ȼ�����2mol�������������Ȼ���ռ���뷴Ӧ��50%��6 molHCl�μӷ�Ӧ���������Ȼ�����3mol��ת�Ƶĵ�����Ϊ3NA=3��6.02��1023 �� �ʴ�Ϊ��MnO2+4H++2Cl��
MnCl2+Cl2��+2H2O��ÿ��4mol HCl���뷴Ӧ�����������Ȼ�����2mol�������������Ȼ���ռ���뷴Ӧ��50%��6 molHCl�μӷ�Ӧ���������Ȼ�����3mol��ת�Ƶĵ�����Ϊ3NA=3��6.02��1023 �� �ʴ�Ϊ��MnO2+4H++2Cl�� ![]() Mn2++2H2O+Cl2����3��6.02��1023����3���������Ư�����������Եģ����������Ư��������ʱ�ģ�����ʱ��������Ư������Һ�ޱ仯�������������ɫ�������ɵ���ɫ���ʲ��ȶ�������ʱ���ɺ�ɫ���ʴ�Ϊ����ɫ��Ʒ���ָֻ��ɺ�ɫ����Һû�����Ա仯����4���������������������ʵ�����Ӧ������������ᣬ��������ᶼ������Ư���ԣ���ѧ����ʽΪ��SO2+Cl2+2H2O=H2SO4+2HCl���ʴ�Ϊ��SO2+Cl2+2H2O=H2SO4+2HCl��
Mn2++2H2O+Cl2����3��6.02��1023����3���������Ư�����������Եģ����������Ư��������ʱ�ģ�����ʱ��������Ư������Һ�ޱ仯�������������ɫ�������ɵ���ɫ���ʲ��ȶ�������ʱ���ɺ�ɫ���ʴ�Ϊ����ɫ��Ʒ���ָֻ��ɺ�ɫ����Һû�����Ա仯����4���������������������ʵ�����Ӧ������������ᣬ��������ᶼ������Ư���ԣ���ѧ����ʽΪ��SO2+Cl2+2H2O=H2SO4+2HCl���ʴ�Ϊ��SO2+Cl2+2H2O=H2SO4+2HCl��
A�����Ʊ�SO2 �� ����Na2SO3�����ᷴӦ��ȡ��B���ڼ��������������ɣ�E��Ũ����Ͷ��������ڼ����������Ʊ�������D���ڼ��������Ư���ԣ�C��������β������1��ʹ�÷�Һ©��ʱӦȡ�����ӣ�ʹ��Һ©���ڵ�ѹǿ���ڴ���ѹǿ����֤Һ��˳����������2��ʵ������װ��E�Ʊ�Cl2 �� Ϊ�������̺�Ũ����ķ�Ӧ�������������ݻ��ϼ۵ı仯����ת�Ƶĵ�����Ŀ����3��SO2��Ư���п����ԣ��������Ư�ײ����棻��4���������н�ǿ�������ԣ�����������н�ǿ�Ļ�ԭ�ԣ��������������������ʵ�����Ӧ������������ᣬ��������ᶼ������Ư���ԣ�


 �»����ܶ�Ա��ϵ�д�
�»����ܶ�Ա��ϵ�д� ����ͼ����ּ��������ҵ֣�ݴ�ѧ������ϵ�д�
����ͼ����ּ��������ҵ֣�ݴ�ѧ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ȼҵ�Ļ���ԭ�����ǵ�ⱥ��ʳ��ˮ�����й���ʵ���ҵ�ⱥ��ʳ��ˮ��˵������ȷ����(����)
A. ����ѡ��ʯī����Ϊ������������,����������Ҳ����������
B. ��ʪ��ĵ���KI��ֽ������������,��ֽ����
C. ��������,������������Һ�еμ�Ʒ��,Ʒ����ɫ
D. ʵ�������,����Һ����,Ȼ����pH��ֽ����,��Һ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������NH4Cl���ᡢNaClO2(�������ɣ�Ϊԭ���Ʊ�C1O2�Ĺ�������ͼ��ʾ��
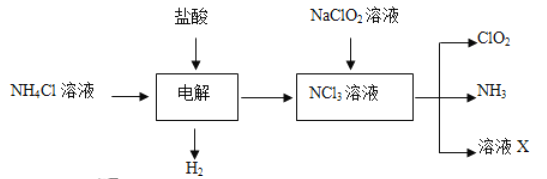
����˵������ȷ����
A. X�д������ڵ���������C1-��OH-
B. NH3��NC13��NԪ�صĻ��ϼ���ͬ
C. NaClO2���ClO2������������Ӧ
D. ��ȡlmolClO2������Ҫ![]() molNH4Cl
molNH4Cl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йػ�ѧ�������ҵ�������У���ȷ���ǣ� ��
A.NaCl����ʳƷ������
B.���ࡢ��֬�������ʶ��Ǹ߷��ӻ�����
C.�����ڳ�ʪ�Ŀ�����������ѧ��ʴ������
D.��ҵ������������ˮ�ࡢƯ�۾���Ҫ�ô���Ϊԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݻ�������ܱ������н��з�Ӧ:2SO2 (g)+O2(g)![]() 2SO3(g)����H<0�����и�ͼ��ʾ��������������ʱ,�ı�ijһ������������Ӧ��Ӱ��,���з�����ȷ���ǣ� ��
2SO3(g)����H<0�����и�ͼ��ʾ��������������ʱ,�ı�ijһ������������Ӧ��Ӱ��,���з�����ȷ���ǣ� ��

A. ͼ����ʾ�¶ȶԻ�ѧƽ���Ӱ��,�Ҽ��¶Ƚϸ�
B. ͼ����ʾt0ʱ��ʹ�ô����Է�Ӧ���ʵ�Ӱ��
C. ͼ����ʾt0ʱ������O2��Ũ�ȶԷ�Ӧ���ʵ�Ӱ��
D. ͼ����a��b��c������ֻ��b���Ѿ��ﵽ��ѧƽ��״̬
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ԭ��������������Ķ�����Ԫ��A��B��C��D�ֱ�λ�ڲ�ͬ��������ֻ��һ�ֽ�����D�ĵ��ʿ�����ˮ�����û���Ӧ��������Һֻ��ʹ��̪��Ϊdz��ɫ��X��Y��Z����A��B��C��ɵĶ�Ԫ���������X����ΪҺ�壬��Z����������̼�����ϡ�����֮��������ת����ϵ�����٢�����Ϊ��ȼ����Ϊ���¡�����������˵������ȷ����
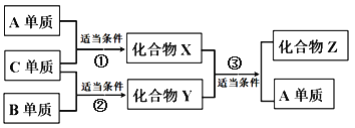
A. D�����Ż�������ĭ��������
B. ������Y��Z��Ϊ���������ձ�����Ҫ��Ⱦ��
C. ԭ��뾶��D>B >C >A
D. ������W��ѧʽΪB2A4����һ��������W������X������Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������мȺ������Ӽ��ֺ��й��ۼ�����
A. ������
B. ����
C. �Ȼ�þ
D. ������̼
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ʵ���ʵ��������������ý�����ȷ���ǣ�
ѡ�� | ʵ���ʵ����� | ���� | ʵ����� |
A | �ô���ʯ�����ᷴӦ��������������ͨ��һ��Ũ�ȵ�Na2SiO3 ��Һ�� | ���ְ�ɫ���� | H2CO3�����Ա�H2SiO3������ǿ |
B | ��ij��Һ�ȵμ������ữ���ٵμ�BaCl2��Һ | �а�ɫ�������� | ԭ��Һ�к���SO42-��SO32-��HSO3-�е�һ�ֻ��� |
C |
| �Թ�b���Թ�a����Һ�ĺ�ɫ�� | ����Ӧ��Ũ�ȣ�ƽ��������Ӧ�����ƶ� |
D |
| ��������Ϊ��ɫ���ұ������Ϊ��ɫ | �����ԣ�Cl2��Br2��I2 |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������н��������ʵ���Һ�������ɲ����գ����Եõ������ʹ������(����)
A. Al2(SO4)3 B. NaHCO3 C. KMnO4 D. FeCl3
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com