
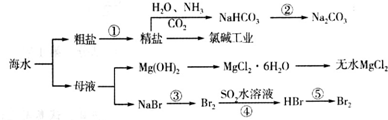
| A、要实现反应②可向NaHCO3溶液中加入过量石灰水 |
| B、溴元素在反应③、⑤中被氧化,在反应④中被还原 |
| C、工业上一般用金属钠与无水MgCl2反应制取Mg单质 |
| D、海水中含有碘元素,可将海水浓缩加热得到碘单质 |


 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
| A、H+、Na+、Cl-、ClO- |
| B、NH4+、NO3-、Cl-、CO32- |
| C、K+、Ca2+、OH-、HCO3- |
| D、Al3+、NO3-、SO42-、MnO4- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学键 | N-H | N-N | O═O | N≡N | O-H |
| 键能(kJ/mol) | 386 | 167 | 498 | 946 | 460 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
| A、放电时负极反应为:Zn-2e-+2OH-=Zn(OH)2 |
| B、充电时阳极反应为:Fe(OH)3-3e-+5OH-=FeO42-+4H2O |
| C、放电时每转移3mol电子,正极有1mol K2FeO4被还原 |
| D、放电时正极附近溶液的酸性增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com