
分析 (1)设NO和NO2的体积分别为x L与yL,则x+y=22.4
由电子得失守恒:($\frac{x}{22.4}$)×3+($\frac{y}{22.4}$)×1=($\frac{22.4}{64}$)×2
据此计算两种气体体积;
(2)生成的氮氧化物又和氧气反应生成硝酸,整个反应过程中Cu失去电子的物质的量等于氧气得到电子的物质的量,据此计算氧气体积.
解答 解:(1)设NO和NO2的体积分别为x L与yL,则x+y=22.4
由电子得失守恒:($\frac{x}{22.4}$)×3+($\frac{y}{22.4}$)×1=($\frac{22.4}{64}$)×2
解得x=4.48、y=2.24,
答:NO和NO2的体积分别为4.48L、2.24L;
(2)生成的氮氧化物又和氧气反应生成硝酸,整个反应过程中Cu失去电子的物质的量等于氧气得到电子的物质的量,设氧气体积为VL,
根据转移电子守恒得n(Cu)×2=$\frac{V}{22.4}$×4
即$\frac{22.4}{64}×2=\frac{V}{22.4}×4$
V=3.92,
答:消耗氧气体积在标况下是3.92L.
点评 本题考查氧化还原反应计算,为高频考点,明确各个物理量之间的关系式是解本题关键,侧重考查学生分析计算及知识的灵活运用,注意转移电子守恒的正确运用,题目难度中等.


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:选择题
| A. | 乙烯和溴单质反应:CH2═CH2+Br2→CH2-CH2Br2 | |
| B. | 合成聚乙烯塑料:nCH2═CH2→ | |
| C. | 皂化反应: +3H2O$→_{△}^{H+}$ +3H2O$→_{△}^{H+}$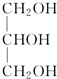 +3C17H35COOH +3C17H35COOH | |
| D. | 乙醇与金属钠反应:2CH3CH2OH+2Na→2CH3CH2ONa+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如表是部分短周期元素的原子半径及常见化合价如表:
如表是部分短周期元素的原子半径及常见化合价如表:| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.099 | 0.074 | 0.102 |
| 常见化合价 | +2 | +3 | -1 | -2 | +6,-2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
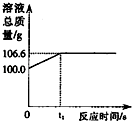 将一定量的CO2通入100g氢氧化钠溶液中恰好完全吸收,形成不饱和溶液,该溶液总质量与反应时间的变化关系如图.试分析解答:
将一定量的CO2通入100g氢氧化钠溶液中恰好完全吸收,形成不饱和溶液,该溶液总质量与反应时间的变化关系如图.试分析解答:查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图I所示的装置能将化学能转变为电能 | |
| B. | 图II所示的反应为吸热反应 | |
| C. | 中和反应中,反应物的总能量比生成物的总能量低 | |
| D. | 化学反应中能量变化的主要原因是化学键的断裂与生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na与O2 | B. | NaOH与CO2 | C. | Ca(OH)2与NaHCO3 | D. | Na2O2 与CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质代号 | A | B | C | D |
| 晶体类型 | 离子晶体 | 原子晶体 | 分子晶体 | 金属晶体 |
| 相应的化学式 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com