
 C(g)+D(g),其化学平衡常数K随温度变化的关系如下表所示,则下列有关判断正确的是
C(g)+D(g),其化学平衡常数K随温度变化的关系如下表所示,则下列有关判断正确的是| T/℃ | 800 | 850 | 1 000 | 1 200 |
| K | 0.9 | 1.0 | 1.7 | 2.4 |
科目:高中化学 来源:不详 题型:填空题
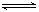 7N2+12H2O可处理NO2。当转移3.6mol电子时,生成的N2在标准状况下是 L。
7N2+12H2O可处理NO2。当转移3.6mol电子时,生成的N2在标准状况下是 L。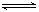 2SO3(g) ΔH =" —196.6" kJ·mol-1
2SO3(g) ΔH =" —196.6" kJ·mol-1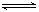 SO3(g)+NO(g) ΔH = —41.8kJ·mol-1
SO3(g)+NO(g) ΔH = —41.8kJ·mol-1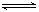 2NO2(g)的 ΔH =" _________" kJ·mol-1
2NO2(g)的 ΔH =" _________" kJ·mol-1 CH3OH(g),达平衡后测得各组分浓度如下:
CH3OH(g),达平衡后测得各组分浓度如下:| 物质 | CO | H2 | CH3OH |
| 浓度(mol?L—1) | 0.9 | 1.0 | 0.6 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
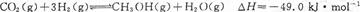
| A.O~1 min | B.1~3 min | C.3~8 min | D.8~11 min |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 Fe(s)+CO2(g) ΔH>0,已知在1100℃时,该反应的化学平衡常数K=0.263。
Fe(s)+CO2(g) ΔH>0,已知在1100℃时,该反应的化学平衡常数K=0.263。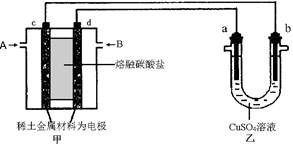
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
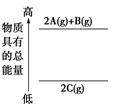
| A.①③⑥ | B.②④⑤ |
| C.①③④ | D.③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.加入醋酸钠 | B.加入ZnCl2 | C.加入铜粉 | D.加入硫酸铜溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
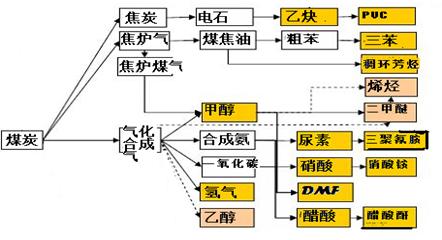
 2CO(g),K1
2CO(g),K1 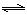 H2(g)+CO2(g),K2
H2(g)+CO2(g),K2 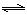 CO(g)+H2(g),K3
CO(g)+H2(g),K3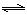 H2(g)+CO2(g),该反应平衡常数随温度的变化如下:
H2(g)+CO2(g),该反应平衡常数随温度的变化如下:| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
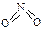 和
和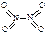 。已知N-N键键能为167kJ·mol-1,NO2中氮氧键的键能为466kJ·mol-1,N2O4中氮氧键的键能为438.5kJ·mol-1。请写出NO2转化为N2O4的热化学方程式为 。
。已知N-N键键能为167kJ·mol-1,NO2中氮氧键的键能为466kJ·mol-1,N2O4中氮氧键的键能为438.5kJ·mol-1。请写出NO2转化为N2O4的热化学方程式为 。 2NO2(g),在温度为T1
2NO2(g),在温度为T1 、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。
、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。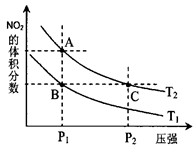
 点的反应速率:A>C
点的反应速率:A>C 查看答案和解析>>
科目:高中化学 来源:不详 题型:判断题
 2SO3”为可逆反应,请回答:
2SO3”为可逆反应,请回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com