


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
A、Na的结构示意图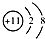 |
| B、多电子原子中,在离核较远区域运动的电子能量较低 |
| C、非金属元素组成的化合物中可能有共价键和离子键 |
| D、HF、HCl、HBr、HI的热稳定性和还原性依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

| 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用10mL量筒量取7.50mL稀盐酸 |
| B、用托盘天平称量出25.20g NaCl晶体 |
| C、用pH试纸测得某碱溶液的pH为12.7 |
| D、用25mL碱式滴定管量出14.08mL NaOH溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com