
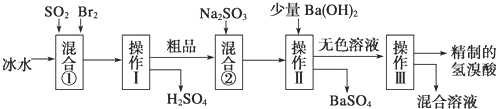
分析 反应①中发生反应 SO2+Br2+2H2O=H2SO4+2HBr,经操作Ⅰ蒸馏得硫酸和氢溴酸的粗品(含溴),反应②中加入Na2SO3还原粗品中的Br2,但会反应生成SO42-,加入氢氧化钡后过滤得硫酸钡沉淀和无色溶液,再蒸馏得到精致的氢溴酸;
(1)分离难溶性固体和溶液采用过滤方法,分离互溶的液体采用蒸馏方法;
(2)溴有毒,且易挥发;
(3)互溶的液体采用蒸馏方法;
(4)混合②中加入Na2SO3,亚硫酸钠具有还原性,能将强氧化剂还原;
(5)操作Ⅱ之前加入的Ba(OH)2要控制用量,如果加入的Ba(OH)2已充足,则溶液中不存在硫酸根离子,该实验中可以用氢氧化钡检验硫酸根离子;
(6)由工艺流程可知,溶液中可能含有Br2,可以用CCl4萃取方法检验,萃取剂和原溶剂不互溶,萃取剂和溶质不反应,且溶质在萃取剂中的溶解度大于在原溶剂中的溶解度.
解答 解:反应①中发生反应 SO2+Br2+2H2O=H2SO4+2HBr,经操作Ⅰ蒸馏得硫酸和氢溴酸的粗品(含溴),反应②中加入Na2SO3还原粗品中的Br2,但会反应生成SO42-,加入氢氧化钡后过滤得硫酸钡沉淀和无色溶液,再蒸馏得到精致的氢溴酸;
(1)分离难溶性固体和溶液采用过滤方法,操作II是分离硫酸钡沉淀和溶液,应该采用过滤方法;
分离互溶的液体采用蒸馏方法,操作III是分离互溶的混合溶液和氢溴酸,采用蒸馏方法,
故答案为:过滤;蒸馏;
(2)Br2氧化SO2放出很多热量,溴易挥发,使用冰水,降低体系温度,防止溴蒸发,使反应完全.
故答案为:降低体系温度,防止溴蒸发,使反应完全;
(3)操作III是蒸馏,互溶的液体采用蒸馏方法,是利用物质沸点不同分离提纯物质,故答案为:d;
(4)混合②中加入Na2SO3,亚硫酸钠具有还原性,能将强氧化剂溴还原生成溴离子,离子方程式为SO32-+Br2+2H2O=2Br-+2H++SO42-,
故答案为:SO32-+Br2+2H2O=2Br-+2H++SO42-;
(5)操作Ⅱ之前加入的Ba(OH)2要控制用量,如果加入的Ba(OH)2已充足,则溶液中不存在硫酸根离子,该实验中可以用氢氧化钡检验硫酸根离子,其检验方法为:取反应后的上层清液少许于试管中,滴加氢氧化钡溶液,若无沉淀证明试剂加入已充分,
故答案为:取反应后的上层清液少许于试管中,滴加氢氧化钡溶液,若无沉淀证明试剂加入已充分;
(6)由工艺流程可知,溶液中可能含有Br2,可以用CCl4萃取方法检验,可以用CCl4萃取方法检验,萃取剂和原溶剂不互溶,萃取剂和溶质不反应,且溶质在萃取剂中的溶解度大于在原溶剂中的溶解度,
故答案为:含有Br2;AC.
点评 本题考查物质制备,为高频考点,涉及物质检验、萃取剂的选取、氧化还原反应、物质分离和提纯等知识点,侧重考查学生对化学工艺流程图的分析、判断及对元素化合物知识的灵活运用,明确物质性质及其差异性、物质分离提纯方法等知识点是解本题关键,注意流程图中发生的反应、各物质中溶质成分及分离方法,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 电解过程中共转移0.4 mol电子 | B. | 原混合液中c(K+)为2.0 mol•L-l | ||
| C. | 电解得到的Cu的质量为6.4 g | D. | 电解后溶液中c(H+)为0.1 mol•L-l |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
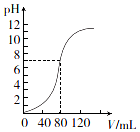 用1.0mol•L-l NaOH溶液中和某浓度H2SO4溶液时,其pH和所加NaOH溶液的体积(V)关系如图所示.则原硫酸溶液的物质的量浓度和恰好中和时溶液的总体积分别是(假设混合后溶液总体积为二者体积之和)( )
用1.0mol•L-l NaOH溶液中和某浓度H2SO4溶液时,其pH和所加NaOH溶液的体积(V)关系如图所示.则原硫酸溶液的物质的量浓度和恰好中和时溶液的总体积分别是(假设混合后溶液总体积为二者体积之和)( )| A. | 0.5 mol•L-1、160 mL | B. | 1.0 mol•L-1、160 mL | ||
| C. | 0.5 mol•L-1、80 ml | D. | 1.0 mol•L-1、80 ml |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
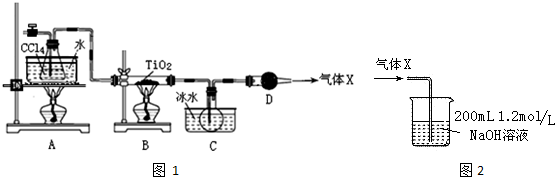
| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76.8 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 化合物 | 密度(g•cm-3) | 水溶性 | 沸点(℃) |
| 冰乙酸 | 1.05 | 易溶 | 118.1 |
| 正丁醇 | 0.80 | 微溶 | 117.2 |
| 正丁醚 | 0.77 | 不溶 | 142.0 |
| 乙酸正丁酯 | 0.90 | 微溶 | 126.5 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 温度 | 25℃ | 50℃ | 95℃ |
| 溶解度 | 0.17g | 0.95g | 6.8g |
| 物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
| 相对分子质量 | 34 | 122 | 136 |
| 沸点/℃ | 64.7 | 249 | 199.6 |
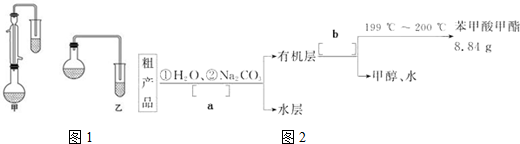
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
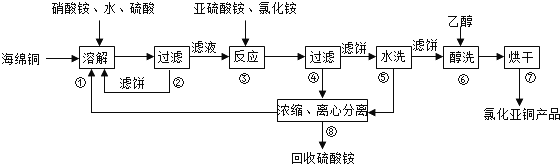
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
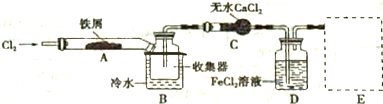

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
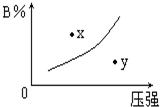 反应mA(s)+nB(g)?pC(g)△H=-QkJ/mol在一定温度下B的体积分数(B%)与压强变化的关系如图所示,下列叙述中正确的是( )
反应mA(s)+nB(g)?pC(g)△H=-QkJ/mol在一定温度下B的体积分数(B%)与压强变化的关系如图所示,下列叙述中正确的是( )| A. | 只有① | B. | 只有②④ | C. | 只有①②④ | D. | 只有①和③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com