
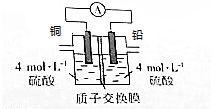
 铅是一种活泼金属,铅与稀硫酸发生的反应为Pb+H2SO4(aq)═PbSO4(s)+H2↑,某同学根据反应设计如下装置:回答下列问题:
铅是一种活泼金属,铅与稀硫酸发生的反应为Pb+H2SO4(aq)═PbSO4(s)+H2↑,某同学根据反应设计如下装置:回答下列问题:分析 (1)电池中Cu的活泼性比铅弱,Cu作正极,电子从负极流向正极;
(2)原电池中化学能转化为电能;
(3)Pb在负极失电子生成PbSO4;氢离子在正极得电子生成氢气;
(4)Pb在负极失电子生成PbSO4,负极增加的质量为硫酸根离子的质量,根据反应方程式计算;
(5)正极的电极方程式为2H++2e-=H2↑,根据电子与氢离子的关系,结合铅离子和硫酸根离子生成的沉淀计算.
解答 解:(1)铅与稀硫酸发生的反应为Pb+H2SO4(aq)═PbSO4(s)+H2↑,利用该反应设计为原电池,电池中Cu的活泼性比铅弱,Cu作正极,Pb的活泼性强,Pb失电子作负极,电子从负极流向正极,即由Pb流向Cu;
故答案为:正极;由Pb流向Cu;
(2)该装置为原电池,原电池中化学能转化为电能;
故答案为:化学能转化为电能;
(3)该装置工作时,Pb在负极失电子生成PbSO4,则负极的电极方程式为:Pb-2e-+SO42-=PbSO4 ;氢离子在正极得电子生成氢气;
故答案为:Pb-2e-+SO42-=PbSO4 ;H2;
(4)Pb在负极失电子生成PbSO4,负极增加的质量为硫酸根离子的质量,则n(SO42-)=$\frac{38.4g}{96g/mol}$=0.4mol,由反应方程式Pb+H2SO4(aq)═PbSO4(s)+H2↑可知,生成氢气为0.4mol,其体积为V=0.4mol×24.5L/mol=9.8L;
故答案为:9.8;
(5)正极的电极方程式为2H++2e-=H2↑,电路上通过了0.6mol电子,则正极消耗氢离子为0.6mol,氢离子向正极移动,所以质子交换膜右侧减少的氢离子离子约为0.6mol,通过0.6mol电子,则会生成0.3molPb2+,Pb2+与SO42-结合生成PbSO4 ,则减少的SO42-为0.3mol,所以质子交换膜右侧减少离子约为0.9mol;
故答案为:0.9.
点评 本题考查原电池的原理,题目难度中等,明确原电池正负极的判断方法及电极方程式的书写方法即可解答,注意电子守恒在计算中的应用,侧重于考查学生的分析能力和计算能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,步骤Ⅱ中,通入一段时间N2的目的是避免对分解产物O2的检验产生干扰.
,步骤Ⅱ中,通入一段时间N2的目的是避免对分解产物O2的检验产生干扰.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na、Mg、Al的第一电离能逐渐增大 | B. | V、Cr、Mn的最外层电子数逐渐增大 | ||
| C. | S2-、Cl-、K+的半径逐渐减小 | D. | O、F、Ne的电负性逐渐增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
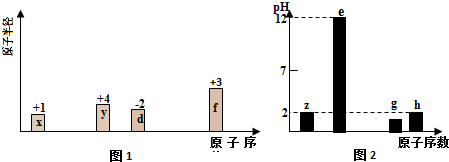
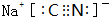 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
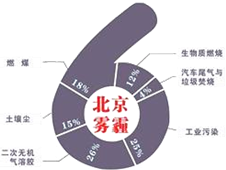 中科院大气研究所研究员张仁健课题组与同行合作,对北京地区PM2.5有6个重要来源,其中,汽车尾气和燃煤分别占4%、18%.用于净化汽车尾气的反应为2NO(g)+2CO(g)$\stackrel{催化剂}{?}$ 2CO2(g)+N2(g),已知该反应在570K时平衡常数为1×1059,但反应很慢.下列说法正确的是( )
中科院大气研究所研究员张仁健课题组与同行合作,对北京地区PM2.5有6个重要来源,其中,汽车尾气和燃煤分别占4%、18%.用于净化汽车尾气的反应为2NO(g)+2CO(g)$\stackrel{催化剂}{?}$ 2CO2(g)+N2(g),已知该反应在570K时平衡常数为1×1059,但反应很慢.下列说法正确的是( )| A. | 装有尾气净化装置的汽车排出的气体中不再含有NO或CO | |
| B. | 提高尾气净化效率的常用方法是升高温度 | |
| C. | 增大压强,上述平衡右移,故实际操作中可通过增压的方式提高其净化效率 | |
| D. | 提高尾气净化效率的最佳途径是使用高效催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钠溶液在电流作用下电离成钠离子和氯离子. | |
| B. | 硫酸钡难溶于水,但硫酸钡是电解质 | |
| C. | 溶于水后电离出氢离子的化合物都是酸 | |
| D. | 二氧化碳的水溶液能导电,故二氧化碳属于电解质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com