
| A. | 恒温恒容:操作1:加1mol N2+3mol H2,操作2:加2mol NH3 | |
| B. | 恒温恒压:操作1:加1mol N2+3mol H2,操作2:加2mol NH3 | |
| C. | 恒温恒容:操作1:加1mol N2+3mol H2,操作2:加3mol NH3 | |
| D. | 恒温恒压:操作1:加1mol N2+3mol H2,操作2:加3mol NH3 |
分析 A、该反应正反应是气体体积减少的反应,恒温恒容下,加操作2转化到左边,可得1 mol N2+3 mol H2,与操作1对应各组分的物质的量相等,与操作1为等效平衡,平衡时NH3的物质的量相同,令操作1中N2的转化率为a,由方程式可知平衡时NH3为2amol;操作2中 NH3的转化率为b,平衡时NH3为2(1-b)mol,据此计算判断;
B、该反应正反应是气体体积减少的反应,恒温恒压下,加操作2转化到左边,可得1 mol N2+3 mol H2,与操作1对应各组分的物质的量之比相等,与操作1为等效平衡,平衡时NH3的含量相同,令操作1中N2的转化率为a,由方程式可知平衡时NH3为2amol,平衡时总的物质的量为(4+2a)mol;操作2中 NH3的转化率为b,平衡时NH3为2(1-b)mol,总的物质的量为(2+2b)mol,根据含量相同计算判断;
C、该反应正反应是气体体积减少的反应,恒温恒容下,加操作2转化到左边,可得1.5 mol N2+4.5mol H2,与操作1对应各组分的物质的量不相等,与操作1不是等效平衡,可等效为在操作2在操作1的基础上增大压强,平衡时NH3含量增大、物质的量比操作1增大,令操作1中N2的转化率为a,由方程式可知平衡时NH3为2amol,平衡时总的物质的量为(4+2a)mol;操作2中 NH3的转化率为b,平衡时NH3为3(1-b)mol,总的物质的量为(3+3b)mol,根据平衡是氨气的含量计算判断;
D、该反应正反应是气体体积减少的反应,恒温恒压下,加操作2转化到左边,可得1.5mol N2+4.5mol H2,与操作1对应各组分的物质的量之比相等,与操作1为等效平衡,平衡时NH3的含量相同,令操作1中N2的转化率为a,由方程式可知平衡时NH3为2amol,平衡时总的物质的量为(4+2a)mol;操作2中 NH3的转化率为b,平衡时NH3为3(1-b)mol,总的物质的量为(3+3b)mol,根据含量相同计算判断.
解答 解:A、该反应正反应是气体体积减少的反应,恒温恒容下,加操作2转化到左边,可得1 mol N2+3 mol H2,与操作1对应各组分的物质的量相等,与操作1为等效平衡,平衡时NH3的物质的量相同,令操作1中N2的转化率为a,由方程式可知平衡时NH3为2amol;操作2中 NH3的转化率为b,平衡时NH3为2(1-b)mol,所以有2amol=2(1-b)mol,整理得a+b=1,故A不符合;
B、该反应正反应是气体体积减少的反应,恒温恒压下,加操作2转化到左边,可得1 mol N2+3 mol H2,与操作1对应各组分的物质的量之比相等,与操作1为等效平衡,平衡时NH3的含量相同,令操作1中N2的转化率为a,由方程式可知平衡时NH3为2amol,平衡时总的物质的量为(4-2a)mol;操作2中 NH3的转化率为b,平衡时NH3为2(1-b)mol,总的物质的量为(2+2b)mol,所以$\frac{2a}{4-2a}$=$\frac{2(1-b)}{2+2b}$,整理得a+b=1,故B不符合;
C、该反应正反应是气体体积减少的反应,恒温恒容下,加操作2转化到左边,可得1.5 mol N2+4.5mol H2,与操作1对应各组分的物质的量不相等,与操作1不是等效平衡,可等效为在操作2在操作1的基础上增大压强,平衡时NH3含量增大、物质的量比操作1增大,令操作1中N2的转化率为a,由方程式可知平衡时NH3为2amol,平衡时总的物质的量为(4-2a)mol;操作2中 NH3的转化率为b,平衡时NH3为3(1-b)mol,总的物质的量为(3+3b)mol,所以$\frac{2a}{4-2a}$<$\frac{3(1-b)}{3+3b}$,整理得a+b<1,故C符合;
D、该反应正反应是气体体积减少的反应,恒温恒压下,加操作2转化到左边,可得1.5mol N2+4.5mol H2,与操作1对应各组分的物质的量之比相等,与操作1为等效平衡,平衡时NH3的含量相同,令操作1中N2的转化率为a,由方程式可知平衡时NH3为2amol,平衡时总的物质的量为(4-2a)mol;操作2中 NH3的转化率为b,平衡时NH3为3(1-b)mol,总的物质的量为(3+3b)mol,所以所以$\frac{2a}{4-2a}$=$\frac{3(1-b)}{3+3b}$,整理得a+b=1,故D不符合;
故选C.
点评 本题考查化学平衡计算、平衡移动、等效平衡等,难度中等,理解等效平衡规律、判断平衡移动是解题的关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 用下列装置制取并收集纯净的氯气,试回答下列问题:
用下列装置制取并收集纯净的氯气,试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
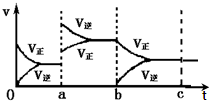 如图表示在密闭容器中反应:2SO2+O2?2SO3+Q达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,ab过程中改变的条件可能是升温;bc过程与ab过程相比化学平衡常数不变.(填“增大”“减小”或“不变”)
如图表示在密闭容器中反应:2SO2+O2?2SO3+Q达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,ab过程中改变的条件可能是升温;bc过程与ab过程相比化学平衡常数不变.(填“增大”“减小”或“不变”)查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 元素X、Y、Z、M、N为短周期主族元素,且原子序数依次增大,已知Y原子最外层电子数与核外电子总数之比为3:4,M原子的最外层电子数与次外层电子数之比为3:4且M原子的质子数是Y原子的2倍,N-、Z+、X+的半径逐渐减小,化合物XN在常温下为气体,据此回答下列问题:
元素X、Y、Z、M、N为短周期主族元素,且原子序数依次增大,已知Y原子最外层电子数与核外电子总数之比为3:4,M原子的最外层电子数与次外层电子数之比为3:4且M原子的质子数是Y原子的2倍,N-、Z+、X+的半径逐渐减小,化合物XN在常温下为气体,据此回答下列问题: .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com