
| A. | 1.35g | B. | 0.27g | C. | 0.54g | D. | 2.7g |
分析 镁铝合金与硫酸反应生成硫酸镁、硫酸铝与氢气,向反应后的溶液中加入0.2 mol•L-1 NaOH溶液至沉淀质量恰好不再变化,铝离子转化为偏铝酸根、镁离子转化为氢氧化镁沉淀,此时溶液中溶质为Na2SO4、NaAlO2,根据硫酸根守恒有n(Na2SO4)=n(H2SO4),根据钠离子守恒有n(NaOH)=2n(Na2SO4)+n(NaAlO2),据此计算n(NaAlO2),再根据铝原子守恒n(Al)=n(NaAlO2),最后根据m=nM计算出铝的质量.
解答 解:镁铝合金与硫酸反应生成硫酸镁、硫酸铝与氢气,向反应后的溶液中加入0.2 mol•L-1 NaOH溶液至沉淀质量恰好不再变化,铝离子转化为偏铝酸根、镁离子转化为氢氧化镁沉淀,此时溶液中溶质为Na2SO4、NaAlO2,
根据硫酸根守恒可知:n(Na2SO4)=n(H2SO4)=0.1L×0.3mol/L=0.03mol,
根据钠离子守恒可知:n(NaOH)=2n(Na2SO4)+n(NaAlO2),故n(NaAlO2)=0.35L×0.2mol/L-0.03mol×2=0.01mol,
根据铝原子守恒可得:n(Al)=n(NaAlO2)=0.01mol,
所以所取样品中铝的质量为:27g/mol×0.01mol=0.27g,
故选B.
点评 本题考查混合物反应的有关计算,题目难度中等,明确发生反应的实质为解答关键,注意掌握守恒思想在化学中的应用方法,试题培养了学生的化学计算能力.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是b
(1)P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是b
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;由A→B的反应类型是:还原反应.
;由A→B的反应类型是:还原反应. .
. 为原料制备化合物X(
为原料制备化合物X( )(结构简式见图)的合成路线流程图(无机试剂可任选).合成路线流程图示例如下:
)(结构简式见图)的合成路线流程图(无机试剂可任选).合成路线流程图示例如下: .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 阳离子 | Fe3+、Al3+、Fe2+、Ba2+、Na+ |
| 阴离子 | Cl-、CO32-、NO3-、SO42-、SiO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.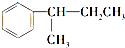 $\stackrel{酸性KMnO_{4}溶液}{→}$
$\stackrel{酸性KMnO_{4}溶液}{→}$ .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 71gCl2中含有NA个Cl2分子 | |
| B. | 常温常压下,14g氮气中含有2NA个氮原子 | |
| C. | 0.5mol•L-1CaCl2溶液中含有0.5NA个Ca2+ | |
| D. | 标准状况下,33.6L水中含有1.5NA个水分子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com