
| A. | 0 | B. | 0.25a | C. | 0.45a | D. | 0.50a |
分析 NaNO3、Cu(NO3)2、AgNO3三种硝酸盐热分解化学方程式如下:
2NaNO3 $\frac{\underline{\;\;△\;\;}}{\;}$2NaNO2+O2↑;
2Cu(NO3)2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+4NO2↑+O2↑;
2AgNO3$\frac{\underline{\;\;△\;\;}}{\;}$2Ag+2NO2↑+O2↑;
由方程式可知,得到的混合气体中n(NO2):n(O2)<4:1,NO2与O2在水中反应的化学方程式如下:4NO2+O2+2H2O═4HNO3,剩余气体只能为O2,混合物中只有NaNO3时,剩余氧气达极大值,若只有Cu(NO3)2时,剩余气体体积达极小值.
解答 解:NaNO3、Cu(NO3)2、AgNO3三种硝酸盐热分解化学方程式如下:
2NaNO3 $\frac{\underline{\;\;△\;\;}}{\;}$2NaNO2+O2↑;
2Cu(NO3)2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+4NO2↑+O2↑;
2AgNO3$\frac{\underline{\;\;△\;\;}}{\;}$2Ag+2NO2↑+O2↑;
由方程式可知,得到氧气物质的量为0.5a mol,得到的混合气体中n(NO2):n(O2)<4:1,NO2与O2在水中反应的化学方程式如下:4NO2+O2+2H2O═4HNO3,剩余气体只能为O2,
混合物中只有NaNO3时,剩余氧气达极大值,剩余氧气极大值为0.5a mol,若只有Cu(NO3)2时,剩余气体体积达极小值0,故0<b<0.5a,
故选:BC.
点评 本题考查混合物计算,关键是根据方程式判断剩余气体,再利用极端法进行解答,注意掌握硝酸盐的分解规律,难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 用电解法精炼铜时,粗铜作阴极、精铜作阳极 | |
| B. | 在镀件上电镀铜时,用金属铜作阳极 | |
| C. | 在电解池中,铜作电极时,溶液中的阴离子在铜极上失电子 | |
| D. | 电解饱和食盐水制稀硫酸制Cl2、H2时,可用金属铜作阳极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
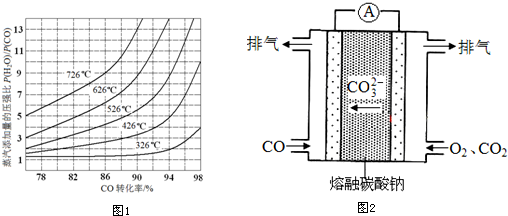
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
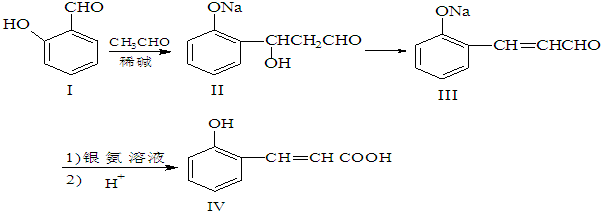
 ;
;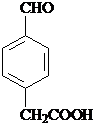 、
、
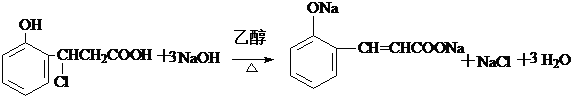 或
或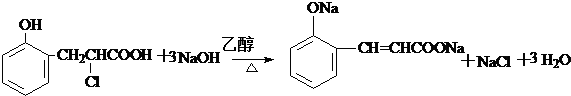 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
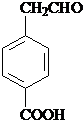
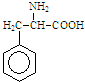 某有机物结构简式如图.一定条件下,该物质与甘氨酸(NH2-CH2-COOH)混合发生反应生成的链状二肽有( )
某有机物结构简式如图.一定条件下,该物质与甘氨酸(NH2-CH2-COOH)混合发生反应生成的链状二肽有( )| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
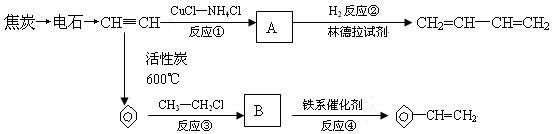
 .
. 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
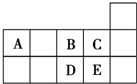
| A. | D在过量的B中燃烧的主要产物为DB3 | |
| B. | C的氢化物的水溶液酸性比E的强 | |
| C. | A与B形成的阴离子可能有AB32-、A2B42- | |
| D. | 原子半径:A>B>C |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
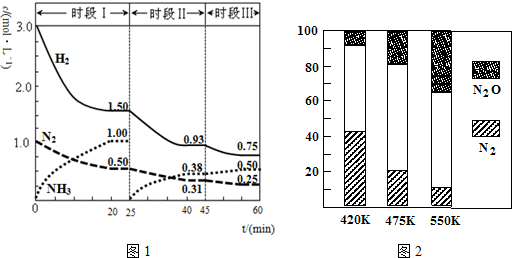
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量:④最大 | |
| B. | ①中水的电离程度最小,③中水的电离程度最大 | |
| C. | 将四份溶液稀释相同倍数后,溶液的pH:④>③,①>② | |
| D. | 将②、③混合,若pH=7,则消耗溶液的体积:②<③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com