
某研究小组将一定质量的镁铝合金材料投入200 mL硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量n(mol)与加入NaOH溶液的体积V(mL)的关系如图所示。
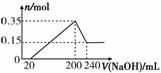
请回答下列问题:
(1)该合金材料中,镁、铝的物质的量之比为______。
(2)硫酸的物质的量浓度为______。
(3)另取相同质量的该合金材料与7.8 g Na2O2一起投入足量的H2O中,最终产生的气体在标准状况下的体积为______。
解析 (1)根据题中图示,反应后最终得到0.15 mol Mg(OH)2,加入200 mL NaOH溶液时,得到Mg(OH)2、Al(OH)3的混合物共0.35 mol,其中Al(OH)3为0.2 mol,此时溶液中的溶质只有Na2SO4。根据原子守恒,合金中Mg、Al的物质的量分别为0.15 mol、0.2 mol,其物质的量之比为3∶4。(2)根据Al(OH)3+NaOH===NaAlO2+2H2O,可得溶解Al(OH)3所需的NaOH为0.2 mol,其体积为0.04 L,故c(NaOH)=0.2 mol/0.04 L=5 mol/L。由沉淀达到最大值时溶液中的溶质只有Na2SO4,得2NaOH~Na2SO4,故c(H2SO4)=200 mL×5 mol/L÷(2×200 mL)=2.5 mol/L。(3)7.8 g Na2O2首先与H2O反应生成0.2 mol NaOH、0.05 mol O2,0.2 mol NaOH与0.2 mol Al刚好反应生成0.3 mol H2,故共有0.35 mol气体产生,在标准状况下的体积为7.84 L。
答案 (1)3∶4 (2)2.5 mol/L (3)7.84 L


 巧学巧练系列答案
巧学巧练系列答案 课课练江苏系列答案
课课练江苏系列答案科目:高中化学 来源: 题型:
物质的量浓度相同的下列溶液:①Na2CO3,②NaHCO3,③H2CO3,④(NH4)2CO3,⑤NH4HCO3,[CO32-]由小到大排列的顺序是( )
A.⑤<④<③<②<①
B.③<⑤<②<④<①
C.③<②<⑤<④<①
D .③<⑤<④<②<①
.③<⑤<④<②<①
查看答案和解析>>
科目:高中化学 来源: 题型:
在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是( )。
A.氯水的颜色呈浅黄绿色,说明氯水中含有Cl2
B.向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl-
C.向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+
D.向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
下列常见实验的现象或表述正确的是( )。
A.向某溶液中加入2滴KSCN溶液,溶液不显红色,再向溶液中加入几滴新制的氯水,溶液变为红色,该溶液中一定含有Fe2+
B.为检验红砖中铁的价态,向红砖粉末中加入盐酸,充分反应后取上层清液于试管中,滴加KSCN溶液2~3滴,溶液变为红色,说明红砖中只有三氧化二铁
C.制备氢氧化亚铁时,向硫酸亚铁溶液中滴加氢氧化钠溶液,边加边搅拌,即可制得白色的氢氧化亚铁
D.将(NH4)2Fe(SO4)2·6H2O试样溶于稀硝酸中,滴加KSCN溶液,出现血红色,说明检验前该试样已变质
查看答案和解析>>
科目:高中化学 来源: 题型:
反应C(s)+H2O(g)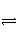
 CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
①增加C的量
②将容器的体积缩小一半
③保持体积不变,充入N2使体系压强增大
④保持压强不变,充入N2使容器的容积变大
A.①③ B.①④ C.②③ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
某探究小组利用丙酮的溴代反应(CH3COCH3+Br2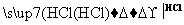 CH3COCH2Br+HBr)来研究反应物浓度与反应速率的关系。反应速率v(Br2)通过测定溴的颜色消失所需的时间来确定。在一定温度下,获得如下实验数据:
CH3COCH2Br+HBr)来研究反应物浓度与反应速率的关系。反应速率v(Br2)通过测定溴的颜色消失所需的时间来确定。在一定温度下,获得如下实验数据:
| 实验 序号 | 初始浓度c/mol·L-1 | 溴颜色消失 所需时间t/s | ||
| CH3COCH3 | HCl | Br2 | ||
| ① | 0.80 | 0.20 | 0.001 0 | 290 |
| ② | 1.60 | 0.20 | 0.001 0 | 145 |
| ③ | 0.80 | 0.40 | 0.001 0 | 145 |
| ④ | 0.80 | 0.20 | 0.002 0 | 580 |
分析实验数据所得出的结论不正确的是( )
A.增大[CH3COCH3],v(Br2)增大
B.实验②和③的v(Br2)相等
C.增大[HCl],v(Br2)增大
D.增大[Br2],v(Br2)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
软锰矿是制备二氧化锰的原料,软锰矿中含有二氧化硅、氧化铜、氧化铁、氧化铝、氧化锌等杂质。工业上以软锰矿为原料制备高纯二氧化锰的工艺流程图如下:
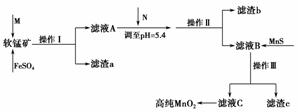
(1)酸性条件下,FeSO4将MnO2还原为MnSO4,那么加入的酸M为________,该反应的离子方程式为______________________________。
(2)制备二氧化锰工艺流程中涉及的阳离子以氢氧化物的形式完全沉淀时溶液的pH如下表:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Mn(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 6.7 | 10.4 |
由流程图信息和表格中数据可知滤渣b的主要成分是________(填化学式)。调节溶液pH=5.4需加入试剂N,N可以是________。
a.CO2 b.稀硫酸 c.NH3 d.氨水
(3)部分硫化物的溶度积常数(Ksp)如下表:
| 硫化物 | CuS | ZnS | MnS | FeS |
| Ksp | 6.3×10-36 | 2.9×10-25 | 2.5×10-13 | 6.3×10-18 |
由表格中的数据推知流程图中向滤液B中加入MnS的作用是__________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com