
| A. | 钠 | B. | 铁 | C. | 铜 | D. | 银 |
分析 根据金属的活泼性不同采用不同的方法,金属的冶炼一般有电解法、热还原法、热分解法、物理分离法.电解法:冶炼活泼金属K、Ca、Na、Mg、Al,一般用电解熔融的氯化物(Al是电解熔融的三氧化二铝)制得;热还原法:冶炼较不活泼的金属Zn、Fe、Sn、Pb、Cu,常用还原剂有(C、CO、H2等);热分解法:Hg、Ag用加热分解氧化物的方法制得,物理分离法:Pt、Au用物理分离的方法制得,
解答 解:A.钠性质活泼,故采用电解法冶炼制备,故A正确;
B.铁性质较不活泼,金属铁的冶炼采用热还原法,故B错误;
C.铜性质较不活泼,金属铜的冶炼采用热还原法,故C错误;
D.银性质稳定,用热分解法冶炼,故D错误;
故选:A.
点评 本题考查金属冶炼的一般方法和原理,注意活泼性不同的金属冶炼的方法不同,本题难度不大.


科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该反应的方程式A+B?C | |
| B. | t1时刻反应达到平衡状态 | |
| C. | t2时刻,正反应速率大于逆反应速率 | |
| D. | 0~30min,用B表示该反应速率为0.03mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
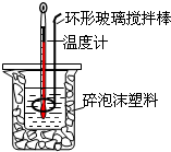
| A. | 使用环形玻璃棒既可以搅拌又避免损坏温度计 | |
| B. | 测了酸后的温度计要用水清洗后再测碱的温度 | |
| C. | 向盛装酸的烧杯中加碱时要小心缓慢以免洒出 | |
| D. | 改变酸碱的用量,所求中和热数值不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用催化剂 | B. | 减小反应体系的压强 | ||
| C. | 降低反应体系的温度 | D. | 将SO3从体系中分离出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 采用“静电除尘”、“燃煤固硫”、“汽车尾气催化净化”可提高空气质量 | |
| B. | 酸性氧化物均能与水反应生成对应的酸,如CO2、SiO2、SO3 | |
| C. | 雷电能固氮属于自然固氮,而工业合成氨及氨的催化氧化均属于人工固氮 | |
| D. | 乙醇、过氧化氢、次氯酸钠等均通过氧化作用达到杀菌消毒的目的 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验 | 装置 |
| (1)实验目的:验证SO2有氧化性 将胶头滴管中浓硫酸分别滴入Y型管的两个支管中,在支管交叉处实验现象为管壁内有淡黄色固体生成;硫化亚铁处加水的目的是稀释浓硫酸,防止硫化氢被氧化. |  |
| (2)实验目的:锌铁合金中铁含量的测定 ①读取量气管中数据时,若发现水准管中的液面低于量气管中液面,应采取的措施是抬高(或移动)水准管位置,使水准管、量气管内液面相平. ②若称得锌铁合金的质量为0.117g,量气管中初读数为1.00mL,末读数为45.80mL,则合金中铁的含量为 69.14%(保留2位小数,气体体积已折算为标况). | 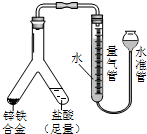 |
| (3)实验目的:探究SO2与BaCl2反应产生沉淀的条件 二氧化硫通入氯化钡溶液并不产生沉淀,而通入另一种气体后可以产生白色沉淀.则右侧Y型管中应放置的药品是浓氨水、碱石灰(必要时可以加热),该沉淀的化学式为BaSO3. | 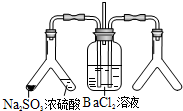 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
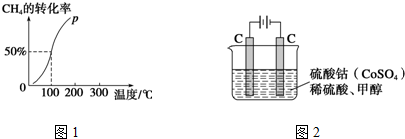
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com