
下列关于实验现象的描述不正确的是( )
A.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡
B.用锌片作负极,铜片作正极,在CuSO4溶液中,铜片质量增加
C.把铜片插入三氯化铁溶液中,在铜片表面出现一层铁
D.把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出的速率加快
科目:高中化学 来源: 题型:
亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,常用于水的消毒以及纺织高漂白。过氧化氢法生产亚氯酸钠的流程图如下

已知NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O且NaClO2在碱性条件下稳定性较高。试回答下列问题:
(1)在ClO2发生器中同时有氯气产生,则在发生器中发生反应的化学方程式为
(2)在NaClO2稳定装置中,H2O2作 (选填序号)。
A.氧化剂 B.还原剂
C.既作氧化剂又作还原剂 D.既不作氧化剂也不作还原剂
(3)在实验室模拟“固体分离装置”中的技术,必须进行的实验操作是 (按实验后顺序填写操作代号)。
A.过滤 B.加热 C.分液 D.蒸馏 E.冷却
(4)经查阅资料知道:当pH≤2.0时,ClO-2能被I完全还原成Cl—;
溶液中Na2S2O3能与I2反应生成NaI和Na2S4O6。
欲测定成品中NaClO2的含量,现进行如下操作:

①步骤Ⅱ中发生反应的离子方程式是 ,
步骤Ⅲ中达到滴定终点时的现象是 。
②若上述滴定操作中用去了V mL Na2S2O3溶液,则样品中NaClO2的质量分数 (用字母表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知25℃、100 kPa条件下:
4Al(s)+3O2(g)===2Al2O3(s) ΔH=-2 834.9 kJ·mol-1
4Al(s)+2O3(g)===2Al2O3(s) ΔH=-3 119.1 kJ·mol-1
由此得出的正确结论是( )
A.等质量的O2比O3能量低,由O2变为O3为吸热反应
B.等质量的O2比O3能量低,由O2变为O3为放热反应
C.O3比O2稳定,由O2变为O3为吸热反应
D.O2比O3稳定,由O2变为O3为放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
已知下列三个热化学方程式
①H2(g)+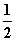 O2(g)===H2O(g) ΔH1=-241.8 kJ·mol-1
O2(g)===H2O(g) ΔH1=-241.8 kJ·mol-1
②C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1
③C(s)+H2O(g)===CO(g)+H2(g) ΔH=131 kJ·mol-1
写出碳燃烧生成CO和CO燃烧的热化学方程式。
查看答案和解析>>
科目:高中化学 来源: 题型:
把A、B、C、D四块金属泡在稀H2SO4中,用导线两两相连可以组成各种原电池。A、B相连时,A为负极;C、D相连时,D上有气泡逸出;A、C相连时,A极减轻;B、D相连时,B为正极。则四种金属的活动性顺序由大到小排列为( )
A.A>B>C>D B.A>C>B>D C.A>C>D>B D.B>D>C>A
查看答案和解析>>
科目:高中化学 来源: 题型:
氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
已知:CH4(g)+H2O(g)====CO(g)+3H2(g) ΔH=206.2 kJ·mol-1
CH4(g)+CO2(g)====2CO(g)+2H2(g) ΔH=247.4 kJ·mol-1
2H2S(g)====2H2(g)+S2(g) ΔH=169.8 kJ·mol-1
(1)以甲烷为原料制取氢气是工业上常用的制氢方法。CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为_______________________。
(2)H2S热分解制氢时,常向反应器中通入一定比例的空气,使部分H2S燃烧,其目的是___________________________ _______________________________;
_______________________________;
燃烧生成的SO2与H2S进一步反应,生成物在常温下均不是气体,写出该反应的化学方程式:_______________________________________。
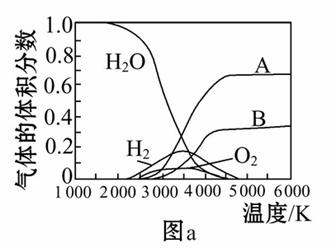
(3)H2O的热分解也可得到H2,高温下水分解体系中主要气体的体积分数与温度的关系如图a所示。图中A、B表示的物质依次是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下取0.2 mol·L-1的盐酸与0.2 mol·L-1的MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6。试回答下列问题:
(1)混合溶液中由水电离出的[H+]____ (填“>”“<”或“=”)0.2 mol·L-1盐 酸中水电离出的[H+]。
酸中水电离出的[H+]。
(2)求混合溶液中下列计算式的精确结果:
[Cl-]-[M+]=_________mol·L-1,[H+]-[MOH]=_________mol·L-1(填具体数字)。
(3)若室温下取0.2 mol·L-1的MOH溶液与0.1 mol·L-1的盐酸等体积混合,测得混合溶液的pH<7,则说明MOH的电离程度__________ (填“>”“<”或“=”)MCl的水解程度,溶液中各离子浓度由大到小的顺序为____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com