
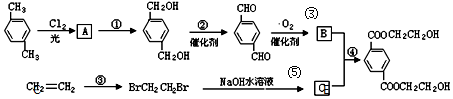
 、B、
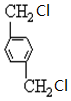
、B、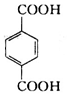 、C.HOCH2CH2OH、
、C.HOCH2CH2OH、 +2NaOH$→_{△}^{H_{2}O}$
+2NaOH$→_{△}^{H_{2}O}$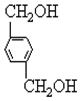 +2NaCl;
+2NaCl; ,反应的化学方程式是
,反应的化学方程式是 +4[Ag(NH3)2]OH$\stackrel{△}{→}$4Ag↓+6NH3↑+
+4[Ag(NH3)2]OH$\stackrel{△}{→}$4Ag↓+6NH3↑+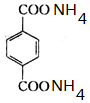 +2H2O.
+2H2O. 分析 对二甲苯和氯气发生取代反应生成A,A发生水解反应生成对二苯甲醇,则A为 ,对二苯甲醇发生催化氧化反应生成对二苯甲醛,对二苯甲醛发生氧化反应生成对二苯甲酸,则B结构简式为
,对二苯甲醇发生催化氧化反应生成对二苯甲醛,对二苯甲醛发生氧化反应生成对二苯甲酸,则B结构简式为 ;乙烯和溴发生加成反应生成1,2-二溴乙烷,1,2-二溴乙烷发生水解反应生成C为HOCH2CH2OH,对二苯甲酸和乙二醇发生酯化反应生成对二苯甲酸乙二酯,结合题目分析解答.
;乙烯和溴发生加成反应生成1,2-二溴乙烷,1,2-二溴乙烷发生水解反应生成C为HOCH2CH2OH,对二苯甲酸和乙二醇发生酯化反应生成对二苯甲酸乙二酯,结合题目分析解答.
解答 解:对二甲苯和氯气发生取代反应生成A,A发生水解反应生成对二苯甲醇,则A为 ,对二苯甲醇发生催化氧化反应生成对二苯甲醛,对二苯甲醛发生氧化反应生成对二苯甲酸,则B结构简式为
,对二苯甲醇发生催化氧化反应生成对二苯甲醛,对二苯甲醛发生氧化反应生成对二苯甲酸,则B结构简式为 ;乙烯和溴发生加成反应生成1,2-二溴乙烷,1,2-二溴乙烷发生水解反应生成C为HOCH2CH2OH,对二苯甲酸和乙二醇发生酯化反应生成对二苯甲酸乙二酯,
;乙烯和溴发生加成反应生成1,2-二溴乙烷,1,2-二溴乙烷发生水解反应生成C为HOCH2CH2OH,对二苯甲酸和乙二醇发生酯化反应生成对二苯甲酸乙二酯,
(1)通过以上分析知,A、B、C结构简式分别为 、
、 、HOCH2CH2OH,
、HOCH2CH2OH,
故答案为: ;
; ;HOCH2CH2OH;
;HOCH2CH2OH;
(2) 发生水解反应生成对二苯甲醇,反应方程式为
发生水解反应生成对二苯甲醇,反应方程式为 +2NaOH$→_{△}^{H_{2}O}$
+2NaOH$→_{△}^{H_{2}O}$ +2NaCl,
+2NaCl,
故答案为: +2NaOH$→_{△}^{H_{2}O}$
+2NaOH$→_{△}^{H_{2}O}$ +2NaCl;
+2NaCl;
(3)含有醛基的物质能发生银镜反应,则 能发生银镜反应,反应方程式为
能发生银镜反应,反应方程式为 +4[Ag(NH3)2]OH $\stackrel{△}{→}$4Ag↓+6NH3↑+
+4[Ag(NH3)2]OH $\stackrel{△}{→}$4Ag↓+6NH3↑+ +2H2O,
+2H2O,
故答案为: ;
; +4[Ag(NH3)2]OH $\stackrel{△}{→}$4Ag↓+6NH3↑+
+4[Ag(NH3)2]OH $\stackrel{△}{→}$4Ag↓+6NH3↑+ +2H2O.
+2H2O.
点评 本题考查有机物推断,为高频考点,侧重考查学生推断能力,明确有机物官能团及其性质关系、有机物之间的转化是解本题关键,知道官能团发生反应条件,题目难度不大.


 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,32gO2含2NA个原子 | |
| B. | 标准状况下,11.2LH2O含有的原子数目为1.5NA | |
| C. | 1mol的Cl-含有NA个电子 | |
| D. | 0.5mol/L的NaCl溶液中Cl-的个数为0.5 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 研究CO、NO、NO2等气体的性质,以便消除污染或变废为宝,可以保护环境、节约资源.试运用所学知识,解决下列问题:
研究CO、NO、NO2等气体的性质,以便消除污染或变废为宝,可以保护环境、节约资源.试运用所学知识,解决下列问题:| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.945795506 | 9 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有②③④ | B. | 只有③⑤ | C. | 只有①④⑥ | D. | 全部 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com