
全固态锂硫电池是一种新型电池,其能且密度约为一般电子设备中广泛使用的锂离子电池的4倍,且成本更低廉.已知锂硫电池的总反应为2Li+S Li2S,用此电池作电源电解足量的AgNO3溶液,其工作原理如下图所示。下列有关说法正确的是
Li2S,用此电池作电源电解足量的AgNO3溶液,其工作原理如下图所示。下列有关说法正确的是
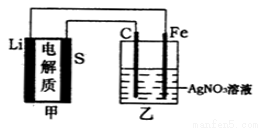
A.乙池溶液中的NO3一移向铁电极
B.乙池石墨电极反应式为Ag++e- =Ag
C.甲池充电时,锂电极发生氧化反应
D.甲池中消耗14g锂,乙池中产生11.2L氧气《标准状况下)
科目:高中化学 来源:2014-2015甘肃省天水市高二下学期第一次月考化学试卷(解析版) 题型:选择题
下图是分离乙酸乙酯、乙酸和乙醇混合物的实验操作流程图

上述试验过程中,所涉及的三次分离操作分别是
A.①蒸馏②过滤③分液 B.①分液②蒸馏③蒸馏
C.①蒸馏②分液③分液 D.①分液②蒸馏③结晶、过滤
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省高三第一次诊断考试理综化学试卷(解析版) 题型:填空题
[化学——选修2:化学与技术](15分)某地煤矸石经预处理后含SiO2( 63%)、Al2O3( 25%) 、Fe2O3(5%)及少量钙镁的化合物等,一种综合利用煤矸石的工艺流程如下图所示。

(1)写出“酸浸”过程中主要反应的离子方程式(任写一个): 。
(2)物质X足量时,“转化”过程中发生反应的有关离子方程式为 。
(3)已知Fe3+开始沉淀和沉淀完全的pH分别为2.1和3.7,A13+开始沉淀和沉淀完全的pH分别为4.1和5.4。为了获得Al( OH)3产品,从煤矸石的盐酸浸取液开始,若只用CaCO3一种试剂,后续的操作过程是 ,然后再加入CaCO3,调节pHCaCO3若只pH到5.4,过滤得到Al( OH)3 。
(4)以煤矸石为原料还可以开发其他产品,例如在煤矸石的盐酸浸取液除铁后,常温下向A1Cl3饱和溶液中不断通入HC1气体,可析出大量A1Cl3·6H2O晶体。结合化学平衡移动原理解释析出晶体的原因: 。
(5)工业上电解冶炼铝的原料用Al2O3而不用A1Cl3其原因是 。电解Al2O3冶炼铝时,阳极材料是 ,阳极需要定期更换,其原因是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省六校联盟高三第三次联考理科综合化学试卷(解析版) 题型:选择题
50℃时,0.1mol·L-1Na2CO3溶液pH=12,下列判断正确的是
A.c(OH-)=10-2mol·L-1
B.加入少量NaOH固体,c(Na+)和c(CO32-)均增大
C.c(Na+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
D.2c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年安徽省皖北协作区高三3月联考理综化学试卷(解析版) 题型:实验题
(14分)锡酸钠(NaBiO3)常用作Mn2十鉴定的强氧化剂。某研究小组用浮选过的辉铋矿(主要成分是Bi2S3.还含少量Bi2O3, SiO2等杂质)制备铋酸钠,其流程如下:
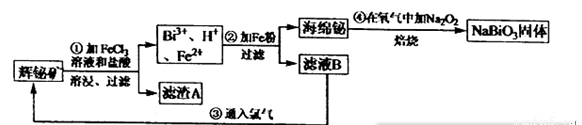
己知:①铋酸钠是一种难溶于水的物质;②BiC13极易水解生成不溶性的BiOCl沉淀,在浓盐酸中几乎不水解;FeC13溶液开始沉淀的pH值为2.7,沉淀完全时的pH值为3.7。
请回答下列问题:
(1)为了提高溶浸工序中原料的浸出率,可以采取的措施 (选滨字母序号)。
a.加入足量的蒸馏水 b.搅拌 c.粉碎矿石 d.升高温度
(2)溶浸时通常加入FeC13溶液和浓盐酸,向其中加入过量浓盐酸的目的是 。
滤渣A的主要成分为 。
(3)铋酸钠可在酸性介质中将Mn2+氧化为MnO4一,故可用于M2+的鉴定。已知NaBiO3被还原为Bi3+试写出该反应的离子方程式: 。
(4)实验室为了测定NaBiO3样品的纯度,需要配制250mL 2.0mo1L-1,FeSO4溶液,所需要的玻璃仪器除烧杯、量筒、玻璃棒外,还需要 、 配制2.0 mo1L-1FeSO4溶液定容时具体的操作步骤为 。
(5)取上述NaBiO3样品10.0g,加入稀硫酸和MnSO4溶液使其完全溶解,然后用新配制的2.0 mo1L-1FeSO4;溶液对生成的MnO4一进行滴定,滴定完成后消耗31.00mL FeSO4溶液。则该样品中NaBiO3纯度为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年安徽省合肥市高三第二次教学质量检测理综化学试卷(解析版) 题型:填空题
(14分)硫代硫酸钠是一种常见的化工原料,将SO2通入按一定比例配成的Na2S和Na2CO3的混合溶液中,便可得到Na2S2O3,其制备反应方程式为:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2
(1)在配制混合溶液前先将蒸馏水加热煮沸一段时间后待用,其目的是 。
(2)用该方法获得的Na2S2O35H2O晶体中常混有一定量的杂质,某兴趣小组欲对其中所含杂质成分进行探究。
【提出假设】该晶体中含有的杂质可能是:Na2CO3、Na2SO3、_____、_____等中的一种或几种,若晶体中混有Na2SO3,则生成Na2SO3的化学方程式为 。
【判断与思考】
某同学取少量制得的晶体溶于足量稀硫酸,并将产生的气体通入CuSO4溶液中,未见黑色沉淀,据此认为晶体中一定不含Na2S,你认为其结论是否合理?_______ (填“合理”、“不合理”)并说明理由:______________
【设计方案进行实验】
若检验晶体中含Na2CO3,完成下表实验方案、现象及结论(仪器自选)。
限选实验试剂:3mol/LH2SO4、1mol/LNaOH酸性KMnO4溶液、饱和NaHCO3溶液、品红溶液、澄清石灰水

(3)已知:2 Na2S2O3+I2=2NaI+Na2S4O6。为测定所制得晶体的纯度,该小组以淀粉作指示剂,用0.010mol/L 的碘水进行多次取样滴定,测得Na2S2O35H2O的含量约为102%。若所用试剂及操作均无不当,产生该结果最可能的原因是______________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年安徽省合肥市高三第二次教学质量检测理综化学试卷(解析版) 题型:选择题
下列各反应对应的离子方程式正确的是
A.向Ca(OH)2溶液中加入过量的NaHCO3溶液Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O
B.向100 mL 0.12 mol/L-1的Ba(OH)2溶液中通入0.02 mol CO2:Ba2++3OH-+2CO2=HCO3-+BaCO3↓+H2O
C.硫酸氢钠与氢氧化钡两种溶液反应后pH恰好为7:H++SO42-+Ba2++OH-=BaSO4↓+H2O
D.向含0.1mol/LNaOH和0.1mol/LNa2CO3的溶液中加入1L0.4mol/L稀盐酸OH-+CO32-+3H+=CO2↑+2H2O
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省上饶市高三第二次高考模拟化学试卷(解析版) 题型:推断题
(15分,除标明外,其余每空2分)吡洛芬是一种用于治疗风湿病的药物。它的合成路线如下:

回答下列问题:
(1)B→C的反应类型为 。
(2)A→B的化学方程式为 。从整个合成路线看,步骤A→B的目的是 。
(3)E的结构简式为 。
(4)A在一定条件下可生成F( )。写出同时满足下列条件的F的两种同分异构体的结构简式: 。
)。写出同时满足下列条件的F的两种同分异构体的结构简式: 。
①属于芳香族化合物
②是一种α-氨基酸
③分子中有6种不同化学环境的氢原子
(5)非那西汀是一种解热药,其结构简式为 。写出以苯酚钠CH3CH2OH和(CH3CO)2O为原料制备非那西汀的合成路线流程图(无机试剂任用)。
。写出以苯酚钠CH3CH2OH和(CH3CO)2O为原料制备非那西汀的合成路线流程图(无机试剂任用)。
合成路线流程图示例如下:
查看答案和解析>>
科目:高中化学 来源:2014-2015黑龙江省哈尔滨市高一下学期第一次月考化学试卷(解析版) 题型:选择题
提出元素周期律并根据周期律编制第一个元素周期表的科学家是
A.道尔顿 B.普利斯特里 C.门捷列夫 D.阿佛加德罗
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com