
【题目】某种有机化合物的结构简式如图所示。有关该物质的说法中正确的是
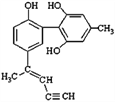
A. 该物质有四种官能团,其中一种名称为羟基
B. 1mol该物质H2反应时最多消耗H2 9mol
C. 滴入酸性KMnO4溶液振荡,紫色褪去,能证明其结构中存在碳碳双键
D. 该分子中的所有碳原子不可能共平面
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:
【题目】某些化学试剂可用于净水。水处理中使用的一种无机高分子混凝剂的化学式可表示为[Al2(OH) nClm·yH2O]X,式中m等于
A. 3-n B. 6-n C. 6+n D. 3+n
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是
A. 1mol/L的NaCl溶液中含有NA个Na+和NA个Cl-
B. 常温常压下,32g的O2和O3混合气体中含有的分子数为2NA
C. 由“CO(g)+2H2(g) ![]() CH3OH(g) ΔH=-129.0kJ/mol”可知:因为该反应是可逆反应,所以每消耗2NA个H2分子时反应放出的热量小于129.0 kJ
CH3OH(g) ΔH=-129.0kJ/mol”可知:因为该反应是可逆反应,所以每消耗2NA个H2分子时反应放出的热量小于129.0 kJ
D. 1L 0.1 mol/L (NH4)2SO4溶液中含N原子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法中正确的是
A. CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0 、△S>0
B. N2(g)+3H2(g)![]() 2NH3(g) △H<0,其他条件不变时升高温度,反应速率v(H2)和氢气的平衡转化率均增大
2NH3(g) △H<0,其他条件不变时升高温度,反应速率v(H2)和氢气的平衡转化率均增大
C. 水解反应NH4++H2O![]() NH3·H2O+H+达到平衡后,升高温度平衡向正反应方向移动
NH3·H2O+H+达到平衡后,升高温度平衡向正反应方向移动
D. 水的离子积常数Kw随着温度的升高而增大,说明水的电离是放热过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一氯化碘是一种红棕色液体,不溶于水,溶于乙醇和乙酸,能与KI反应生成I2,用于测定油脂中的碘值等(注:碘值表示有机物中不饱和程度的指标)。某校研究性学习小组的同学拟制备一氯化碘(沸点101 ℃)。回答下列问题:
(1)甲组同学拟利用干燥纯净的氯气与碘反应制备一氯化碘,已知碘与氯气的反应为放热反应,其装置如下:
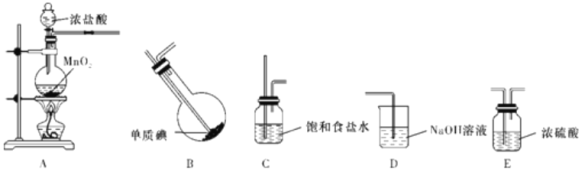
①各装置连接顺序为A→_______________________;
A中发生反应的离子方程式为________________________。
②B装置烧瓶需放在冷水中,其目的是________________________;
D装置的作用是________________________。
③B装置得到的液态产物进一步提纯可得到较纯净的ICl,采取的方法是_____。
(2)乙组同学采用最新报道制一氯化碘的方法,在三颈烧瓶中加入粗碘和盐酸,控制温度约50 ℃,在不断搅拌下逐滴加入氯酸钠溶液,生成一氯化碘,则发生反应的化学方程式为_________________________。
(3)设计实验证明:ICl的氧化性比I2强:_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某浅绿色晶体X[x(NH4)2SO4·yFeSO4·zH2O]在分析化学中常用作还原剂. 为确定其组成,某小组同学进行如下实验.
I.NH4+的测定
采用蒸馏法,蒸馏装置如图所示。

相关的实验步骤如下:
①准确称取58.80g晶体X,加水溶解后,将溶液注入三颈烧瓶中;
②准确量取50.00mL3.0300molL-1H2SO4溶液于锥形瓶中;
③向三颈烧瓶中加入足量NaOH溶液,通入氮气,加热,蒸氨结束后取下锥形瓶;
④用0.120molL-1NaOH标准溶液滴定锥形瓶中过量的硫酸,滴定终点时消耗25.00mL NaOH标准溶液.
(1)仪器M的名称为__________。
(2)步骤③中,发生的氧化还原反应的化学方程式为____________。蒸氨结束后,为了减少实验误差,还需要对直形冷凝管进行“处理”,“处理”的操作方法是_____________。
(3)步骤④中,若振荡时锥形瓶中有液体溅出,则所测得的n(NH4+)的值将______(填“偏大”“偏小”或“不变”)。
II.SO42-含量的测定
采用重量分析法,实验步骤如下:
①另准确称取58.80g晶体X 于烧杯中,加水溶解,边搅拌边加入过量的BaCl2溶液;
②将得到的溶液用无灰滤纸(灰分质量很小,可忽略)过滤,洗涤沉淀3~4次;
③用滤纸包裹好沉淀取出,灼烧滤纸包至滤纸完全灰化;
④继续灼烧沉淀至恒重、称量,得沉淀质量为69.90g。
(4)步骤①中,判断BeCl 溶液已过量的实验操作和现象是___________。
(5)步骤②中,采用冷水洗讓沉淀,其主要目的是___________。
(6)结合实验Ⅰ、Ⅱ通过计算得出晶体X的化学式为__________。实验I 的步骤①中,溶液中离子溶度由大到小的顺序为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com