
【题目】今有Na2CO3、NaHCO3、NaCl组成的混合物100g,加热到质量不再减少为止。剩余残渣为84.5g,将残渣溶于水,滴入足量的AgNO3溶液得到白色沉淀,加足量的稀硝酸后大部分沉淀消失,剩余沉淀为12.26g,试计算混合物中Na2CO3、NaHCO3和NaCl的质量分数各是多少?
【答案】解答:设NaHCO3的质量为x,NaCl的质量为y
2NaHCO3 ![]() Na2CO3+CO2↑+H2O Δm
Na2CO3+CO2↑+H2O Δm
168 62
x 100g-84.5g
列比例式 ![]() 解之,x=42g
解之,x=42g
NaCl+AgNO3====AgCl↓+NaNO3
58.5 143.5
y 12.26g![]() 解之,y=5g
解之,y=5g
m(Na2CO3)=100g-42g-5g=53g
由于混合物的总质量为100g,故混合物中Na2CO3、NaHCO3和NaCl的质量分数分别为53%、42%、5%。
【解析】设法求出100g混合物中各物质的质量,即可求出成分的质量分数。加热到质量不再减少为止,减少的质量为2NaHCO3 ![]() Na2CO3+CO2↑+H2O 生成的CO2和H2O的质量,可根据方程式求出NaHCO3的质量。根据题意知12.26g沉淀为AgCl,可方程式NaCl+AgNO3====AgCl↓+NaNO3求出NaCl的质量。NaHCO3和NaCl的质量求出后,原混合物中Na2CO3的质量也就可求出了。
Na2CO3+CO2↑+H2O 生成的CO2和H2O的质量,可根据方程式求出NaHCO3的质量。根据题意知12.26g沉淀为AgCl,可方程式NaCl+AgNO3====AgCl↓+NaNO3求出NaCl的质量。NaHCO3和NaCl的质量求出后,原混合物中Na2CO3的质量也就可求出了。


科目:高中化学 来源: 题型:
【题目】一定条件下,可逆反应X(g)+3Y(g)2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0),平衡时X、Y、Z的浓度分别为0.1molL﹣1、0.3molL﹣1、0.08molL﹣1 , 则下列判断正确的是( )
A.c1:c2的值不能确定
B.平衡时,Y和Z的生成速率之比为1:1
C.0.48molL﹣1<c1+c2+c3<0.56molL﹣1
D.c1的取值范围为0<c1<0.14 molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁电池是一种新型可充电电池,与普通电池相比,该电池能较长时间保持稳定的放电电压.高铁电池的总反应为:请回答下列问题:
3Zn+2K2FeO4+8H2O ![]() 3Zn(OH)2+2Fe(OH)3+4KOH.
3Zn(OH)2+2Fe(OH)3+4KOH.
(1)高铁电池的负极材料是 .
(2)放电时,正极发生(填“氧化”或“还原”)反应;已知负极反应为Zn﹣2e﹣+2OH﹣═Zn(OH)2 , 则正极反应为 .
(3)放电时,(填“正”或“负”)极附近溶液的碱性增强.
(4)充电时,阴极的电极反应式为 .
(5)充电时,理论上分析,每生成0.15moLK2FeO4转移电子数为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上将相同物质的量的NaCl、CO2、NH3在30℃时配成溶液,此时溶液中无晶体。当降温至某温度时,开始析出晶体,此晶体是( )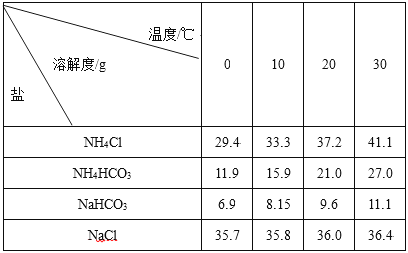
A.NH4Cl
B.NH4HCO3
C.NaHCO3
D.NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列短周期元素性质的数据:下列关于表中11种元素的说法正确的是( )
元素 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | |
原子半径(10﹣10m) | ﹣ | 0.37 | 0.74 | 0.75 | 0.77 | 0.82 | 0.99 | 1.10 | 1.52 | 1.60 | 1.86 |
最高或最 | 0 | +1 | +5 | +4 | +3 | +7 | +5 | +1 | +2 | +1 | |
﹣2 | ﹣3 | ﹣4 | ﹣1 | ﹣3 |
A.上表中11种元素中形成的非金属单质都有非极性共价键
B.②⑨处于同一周期,④⑧处于同一主族
C.上表中11种元素中最高价氧化物对应的水化物中⑦号酸性最强
D.⑥原子结构示意图为 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验能达到目的的是
A. 只滴加氨水鉴别AlCl3、MgCl2溶液
B. 将NH4Cl溶液蒸干制备NH4Cl固体
C. 用萃取分液的方法除去酒精中的水
D. 用可见光束照射以区别溶液和胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有较大量的Cl-、CO32-、OH-3种阴离子,如果只取一次该溶液就能分别将3种阴离子依次检验出来,下列实验操作顺序(滴加的试剂均过量)正确的是( )
①滴加Mg(NO3)2溶液; ②过滤; ③滴加AgNO3溶液; ④滴加Ba(NO3)2溶液
A.①②④②③B.①②③②④C.④②①②③D.④②③②①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸工业在国民经济中占有极其重要的地位。
(1)硫酸的最大消费渠道是化肥工业,用硫酸制造的常见化肥有(任写一种)。
(2)硫酸生产中,根据化学平衡原理来确定的条件或措施有________(填写序号)。
A.矿石加入沸腾炉之前先粉碎
B.使用V2O5作催化剂
C.转化器中使用适宜的温度
D.净化后的炉气中要有过量的空气
E.催化氧化在常压下进行
F.吸收塔中用98.3%的浓硫酸吸收SO3
(3)在硫酸工业中,通过下列反应使二氧化硫转化为三氧化硫:2SO2(g)+ ![]() O2(g)
O2(g) ![]() 2SO3(g) ΔH=-98.3 kJ·mol-1。在实际工业生产中,常采用“二转二吸法”,即将第一次转化生成的SO3分离后,将未转化的SO2进行二次转化,假若两次SO2的转化率均为95%,则最终SO2的转化率为。
2SO3(g) ΔH=-98.3 kJ·mol-1。在实际工业生产中,常采用“二转二吸法”,即将第一次转化生成的SO3分离后,将未转化的SO2进行二次转化,假若两次SO2的转化率均为95%,则最终SO2的转化率为。
(4)硫酸的工业制法过程涉及三个主要的化学反应及相应的设备(沸腾炉、转化器、吸收塔)。
①三个设备分别使反应物之间或冷热气体之间进行“对流”。请简单描述吸收塔中反应物之间是怎样对流的。。
②工业生产中常用氨-酸法进行尾气脱硫,以达到消除污染、废物利用的目的。用化学方程式表示其反应原理。(只写出2个方程式即可).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com