


 .
. .
. .
. .
. 分析 丙烯与氯气在加热条件下发生取代反应生成CH2=CHCH2Cl,CH2=CHCH2Cl在氢氧化钠水溶液、加热条件下发生水解反应生成醇,故A为CH2=CHCH2OH,A发生氧化反应生成B为CH2=CHCHO,根据信息②可知B与过氧化物得到C为HOCH2CH2CHO,C与氢气发生加成反应生成D为HOCH2CH2CH2OH.对二甲苯发生氧化反应生成E为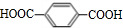 ,D与E发生水解反应生成高聚物W为
,D与E发生水解反应生成高聚物W为 ,据此解答.
,据此解答.
解答 解:丙烯与氯气在加热条件下发生取代反应生成CH2=CHCH2Cl,CH2=CHCH2Cl在氢氧化钠水溶液、加热条件下发生水解反应生成醇,故A为CH2=CHCH2OH,A发生氧化反应生成B为CH2=CHCHO,根据信息②可知B与过氧化物得到C为HOCH2CH2CHO,C与氢气发生加成反应生成D为HOCH2CH2CH2OH.对二甲苯发生氧化反应生成E为 ,D与E发生水解反应生成高聚物W为
,D与E发生水解反应生成高聚物W为 ,
,
(1)由上述分析可知,A的结构简式是CH2=CHCH2OH,HOCH2CH2CH2OH中含有3种氢原子,核磁共振氢谱图中有3种峰,故答案为:CH2=CHCH2OH;3;
(2)由上述分析可知,C为HOCH2CH2CHO,含有的官能团为羟基和醛基,故答案为:羟基;醛基;
(3)由上述分析可知,B发生信息反应与水加成生成C,所以B→C反应类型为加成反应,故答案为:加成反应;
(4)由上述分析可知,B为CH2=CHCHO,含有醛基,所以可以发生能发生银镜反应,能使溴水褪色;含有双键,则可以发生聚合反应,故选:abd;
(5)①A→B的反应方程式为:2CH2=CHCH2OH+O2$→_{△}^{Cu}$2CH2=CHCHO+2H2O,故答案为:2CH2=CHCH2OH+O2$→_{△}^{Cu}$2CH2=CHCHO+2H2O;
②D+E→W的反应方程式为: ,
,
故答案为: ;
;
③HOCH2CH2CH2OH的同分异构体和 的同分异构体反应生成最小环酯为
的同分异构体反应生成最小环酯为 ,故答案为:
,故答案为: ;
;
(6)ⅰ.①遇FeCl3溶液显紫色 ②可发生银镜反应 ③能发生水解反应,含有酚羟基、醛基、酯基,符合条件的同分异构体有: ,取代基位置可以互换;
,取代基位置可以互换;
故答案为: ;
;
ⅱ.①遇FeCl3溶液显紫色 ②可发生银镜反应 ③能和NaHCO3发生反应生成CO2,含有酚羟基、羧基、醛基,符合条件的同分异构体有: ,取代基位置可以互换;
,取代基位置可以互换;
故答案为: .
.
点评 本题考查有机物推断,注意根据反应条件进行推断,需要学生熟练掌握官能团的性质与转化,注意对反应信息的理解,较好的考查学生的自学能力与知识迁移应用,难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下2.24 L己烷中,分子数为0.1NA | |
| B. | 22.4 L Cl2含有Cl-Cl键数为NA | |
| C. | 常温常压下16 g O2和O3混合气体中,氧原子数为NA | |
| D. | 7.8 g Na2O2与足量水反应,转移电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图是某学校实验室从化学试剂商店买回的浓盐酸试剂标签上的部分内容.现用该浓盐酸配制250mL 2mol•L-1的稀盐 酸.可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙; ⑤量筒;⑥托盘天平;⑦玻璃棒.请回答下列问题:
如图是某学校实验室从化学试剂商店买回的浓盐酸试剂标签上的部分内容.现用该浓盐酸配制250mL 2mol•L-1的稀盐 酸.可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙; ⑤量筒;⑥托盘天平;⑦玻璃棒.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等.已知:
CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等.已知:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在一个容积为2L的密闭容器中,加入0.8mol的A2气体和0.6molB2气体,一定条件下发生如下反应:A2(g)+B2(g)?2AB(g)△H<0,反应中各物质的浓度随时间的变化情况如图所示.
在一个容积为2L的密闭容器中,加入0.8mol的A2气体和0.6molB2气体,一定条件下发生如下反应:A2(g)+B2(g)?2AB(g)△H<0,反应中各物质的浓度随时间的变化情况如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 全部 | B. | ②④⑤ | C. | ②③⑤ | D. | ②③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com