
| A. | c(B2-)+c(HB-)+c(H2B)=0.1 mol/L | B. | c(Na+)+c(H+)=c(OH-)+c(HB-)+c(B2-) | ||
| C. | c(OH-)=c(H+)+c(HB-) | D. | c(Na+)=2c(B2-)+c(HB-) |
分析 H2B第一步完全电离、第二步部分电离,则HB-只能电离不能水解,说明B2-离子水解而HB-不水解,且HB-是弱酸,则Na2B溶液呈碱性;任何电解质溶液中都存在电荷守恒和物料守恒,据此分析解答.
解答 解:H2B第一步完全电离、第二步部分电离,则HB-只能电离不能水解,说明B2-离子水解而HB-不水解,且HB-是弱酸,则Na2B溶液呈碱性,
A.H2B第一步完全电离,所以溶液中不存在H2B,则c(H2B)=0,根据原子守恒应该为c(B2-)+c(HB- )+c(H2B)=0.1mol/L,故A正确;
B.根据电荷守恒得:c(Na+)+c(H+ )=c(OH- )+c(HB-)+2c(B2- ),故B错误;
C.H2B第一步完全电离,所以溶液中不存在H2B,溶液中存在质子守恒,根据质子守恒得:c(OH-)=c(H+)+c(HB-),故C正确;
D.根据物料守恒得c(Na+)=2c(B2- )+2c(HB- ),故D错误;
故选AC.
点评 本题考查了离子浓度大小比较,题目难度中等,注意该酸第一步完全电离、第二步部分电离,导致溶液中不存在H2B,为易错点,再结合守恒思想解答.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在这2 min内A浓度减少了0.8 mol/L | |
| B. | 分别用B、C、D表示的反应速率的比值为3:2:1 | |
| C. | 在2 min末的反应速率,用B表示是:0.3 mol/(L•min) | |
| D. | 在这2 min内用D表示的化学反应速率为:0.2mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 此反应中水既不是氧化剂又不是还原剂 | |
| B. | 试管内溶液中溶质的物质的量浓度为$\frac{1}{22.4}$mol/L | |
| C. | 溶液体积占试管容积的三分之二 | |
| D. | 若将试管中的气体换为氯化氢或者氨气,则水充满试管 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
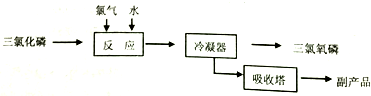
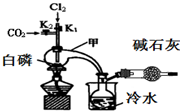 三氯化磷($\stackrel{+3}{P}$Cl3)和三氯氧磷(POCl3)是两种遇水会强烈水解的物质.PCl3是合成药物的重要化工原料;POCl3用于制取染料中间体,有机合成的氯化剂、催化剂和阻燃剂,还常用作半导体掺杂剂及光导纤维原料.
三氯化磷($\stackrel{+3}{P}$Cl3)和三氯氧磷(POCl3)是两种遇水会强烈水解的物质.PCl3是合成药物的重要化工原料;POCl3用于制取染料中间体,有机合成的氯化剂、催化剂和阻燃剂,还常用作半导体掺杂剂及光导纤维原料.| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 |
| 白磷 | 44.1 | 280.5 | 1.82 |
| PCl3 | -112 | 75.5 | 1.574 |
| POCl3 | 2 | 105.3 | 1.675 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向某无色溶液中加BaCl2溶液产生不溶于稀HNO3的白色沉淀,说明原溶液中一定有SO42- | |
| B. | 向某无色溶液中加入盐酸,有无色无味的气体产生,则说明原溶液中一定有CO32- | |
| C. | 向某溶液中滴加KSCN溶液,溶液不变红,再滴加氯水,变红,说明原溶液一定有Fe2+ | |
| D. | 向某无色溶液中加浓NaOH溶液并加热,产生能使湿润的蓝色石蕊试纸变红的气体,则说明原溶液中一定有NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com