
(16分)已知A、B、C、D、E、F、G和H都是元素周期表中前36号的元素,它们的原子序数依次增大。A是周期表中原子半径最小的元素,B原子最外层电子数是内层电子数的两倍,C的基态原子核外有7种不同运动状态的电子,E是电负性最大的元素,F的氢化物和最高价氧化物对应的水化物均为强酸,G、H分别是周期表中1—18纵列中的第10、12纵列元素。请回答下列问题:
(1)D元素在周期表位置是 ,G的核外价层电子排布式为 。
(2)E与A形成的化合物比F与A形成的化合物的沸点 (填“高”或“低”),其原因是 。
(3)B、C原子的第一电离能较大的是 (填元素符号),其原因是 。
(4)BD32-离子中B原子采取 杂化,任写一种与BD互为等电子体的分子的电子式 。
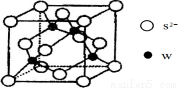
(5)元素H的一种硫化物晶体的晶胞结构如图所示,该硫化物的化学式是 。元素H的氢氧化物可溶于氨水中,生成和铜氨配离子相同配位数的离子,写出该反应的离子方程式为 。
(1)第二周期,第VIA族(2分),3d84s2(2分)。
(2)高(1分),HF分子间存在氢键(1分)。
(3)N(1分),N原子的p轨道是半充满状态(1分)。



 (4)sp2(2分), N N(2分)。
(4)sp2(2分), N N(2分)。
(5)ZnS(2分)。 Zn(OH)2+4NH3=[ Zn (NH3)4]2++2OH-(2分)。
【解析】
试题分析:根据题意知,A、B、C、D、E、F、G和H都是元素周期表中前36号的元素,它们的原子序数依次增大。A是周期表中原子半径最小的元素,则A为氢元素;B原子最外层电子数是内层电子数的两倍,则B为碳元素;C的基态原子核外有7种不同运动状态的电子,则C为氮元素;E是电负性最大的元素,则E为氟元素;又它们的原子序数依次增大,则D为氧元素;F的氢化物和最高价氧化物对应的水化物均为强酸,则F为氯元素;G、H分别是周期表中1—18纵列中的第10、12纵列元素,则G为镍元素,H为锌元素。(1)D为氧元素,在周期表位置是第二周期,第VIA族;,G为28号元素镍元素,核外价层电子排布式为3d84s2;(2)HF比HCl的沸点高,其原因是HF分子间存在氢键;(3)C、N原子的第一电离能较大的是N,其原因是N原子的p轨道是半充满状态,较稳定;(4)根据价层电子对互斥理论判断,CO32-离子中C原子采取sp2杂化,根据等电子体的概念判断,与CO互为等电子体的分子为N2,电子式见答案。(5)根据锌的硫化物晶体的晶胞结构,利用切割法判断,该硫化物的化学式是ZnS。元素锌的氢氧化物可溶于氨水中,生成和铜氨配离子相同配位数的离子,该反应的离子方程式为Zn(OH)2+4NH3=[ Zn (NH3)4]2++2OH-。
考点:考查物质结构与性质,涉及元素推断、核外电子排布式、氢键、电离能、杂化轨道的判断、配合物知识及离子方程式的书写。


科目:高中化学 来源:2013-2014四川省资阳市高一下学期期末考试化学试卷(解析版) 题型:简答题
(5分)某含C、H、O三种元素的有机物4.6 g完全燃烧,若将生成的气体全部通过浓硫酸,则浓硫酸质量增加5.4 g;若将生成的气体全部通过足量的过氧化钠,过氧化钠的质量增加6.2 g(假定气体全部吸收)。
(1)试通过计算推断该有机物的分子式。
(2)该有机物有多种同分异构体,其中一种能和Na反应生成H2,请试写出该有机物的结构简式:________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省资阳市二下学期期末考试化学试卷(解析版) 题型:选择题
能正确表示下列反应的离子方程式是
A.NaHCO3的水【解析】
HCO3-+H2O=CO32-+H3O+
B.用银氨溶液检验乙醛的醛基:
CH3CHO+2Ag(NH3)2OH CH3COO-+NH4++3NH3+2Ag↓+H2O
CH3COO-+NH4++3NH3+2Ag↓+H2O
C.向苯酚钠溶液中通入少量的CO2:CO2+H2O+2C6H5O- 2C6H5OH+2CO32-
2C6H5OH+2CO32-
D.泡沫灭火剂的原理:Al3++3HCO3-=Al(OH)3↓+3CO2↑
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省绵阳市高三第三次诊断性考试理综化学试卷(解析版) 题型:实验题
(16分)某化学兴趣小组设计实验,用浓硫酸与铜反应制得SO2并进行相关实验探究。
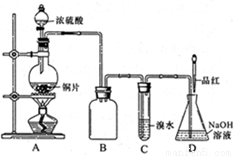
(1)装置A中发生反应的化学方程式
是_______,装置B的作用是_______。
设计装置C的目的是验证SO2的
_______________性,D中NaOH全部转化为
NaHSO3的标志是____________。
(3)反应结束时烧瓶中Cu有剩余,某
同学认为H2SO4也有剩余,他设计了下列实
验方案来测定剩余H2SO4的量。经冷却,定
量稀释后进行下列实验,能达到目的是________(填序号);
a. 用酸碱中和滴定法测定 b. 与足量Zn反应,测量生成H2的体积
c. 用PH计测溶液PH值 d. 与足量BaCl2溶液反应,称量生成沉淀的质量
(4)向D瓶所得NaHSO3溶液中加入漂白粉溶液,反应有三种可能情况:
I. HSO3-与ClO-刚好反应完; II. 漂白粉不足; III. 漂白粉过量
同学们分别取上述混合溶液于试管中,通过下列实验确定该反应属于哪一种情况,请你完成下表:
实验序号 | 实验操作 | 现象 | 反应的可能情况 |
① | 滴加少量淀粉碘化钾溶液,振荡 |
| III |
② | 滴加少量棕红色的KI3溶液,振荡 |
| II |
③ | 滴入加少量酸性KMNO4溶液,振荡 | 溶液呈紫色 |
|
④ | 加入几小块CaCO3固体 | 有气泡产生 |
|
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省绵阳市高三第三次诊断性考试理综化学试卷(解析版) 题型:选择题
揭示下列变化的离子方程式正确的是
A. 明矾用于净水:A3++3H2O=Al(OH)3↓+3H+
B. 钢铁吸氧腐蚀的负极反应:Fe-3e-=Fe3+
C. 向明矾溶液中加入少量氢氧化钡溶液:Al3++SO42-+Ba2++3OH-=BaSO4↓+Al(OH)3↓
D. 苯酚钠饱和溶液中通入少CO2: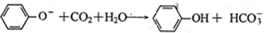
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省攀枝花市高一(下)学期调研检测化学试卷(解析版) 题型:填空题
按要求回答下列问题:
(1)有下列六种物质:①碳60(C60)晶体②硼晶体③Na2O晶体④ CaF2晶体⑤P4O10晶体⑥碳化硅晶体。其中属于离子晶体的是 ,属于分子晶体的是 ,属于原子晶体的是____。
(2)有下列分子:HCN、P4、SO3、PCl3、BF3,其中属于非极性分子的是 。
(3)有下列离子:SO32-、SO42-、CO32-,其中VSEPR模型为正四面体形的是 ,中心原子的杂化轨道类型属于sp2杂化的是 。
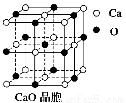
(4)CaO晶胞如右图所示,CaO晶体中Ca2+的配位数为______;与每一个钙离子距离最近并且距离相等的钙离子有____个 ;CaO晶体和NaCl晶体的晶格能分别为:CaO:3 401 kJ/mol、NaCl:786 kJ/mol。导致两者晶格能差异的主要原因_______________。
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省攀枝花市高一(下)学期调研检测化学试卷(解析版) 题型:选择题
下列原子与氢原子形成的共价键中,极性最强的是
A.F B.ClC.N D.O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com